
| A. | c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+) | |
| B. | Ka1(H2CO3)•Ka2(H2CO3)<KW | |
| C. | c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 加入适量NaOH溶液后:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) |
分析 A.室温下,0.1mol•L-1NaHCO3溶液的pH=8.31,溶液呈碱性,说明HCO3-的水解程度大于电离程度,但其电离和水解程度都较小,水电离也生成氢氧根离子;
B.Ka1(H2CO3)•Ka2(H2CO3)=$\frac{c({H}^{+}).c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$.$\frac{c({H}^{+}).c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断.
解答 解:A.室温下,0.1mol•L-1NaHCO3溶液的pH=8.31,溶液呈碱性,说明HCO3-的水解程度大于电离程度,但其电离和水解程度都较小,水电离也生成氢氧根离子,钠离子不水解,所以离子浓度大小顺序是
c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)故A错误;
B.Ka1(H2CO3)•Ka2(H2CO3)=$\frac{c({H}^{+}).c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$.$\frac{c({H}^{+}).c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$,碳酸和碳酸氢根离子都部分电离,所以$\frac{c({H}^{+}).c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$<c(H+),$\frac{c({H}^{+}).c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$<c(H+),因为室温下纯水中,c(OH-)=c(H+),所以Ka1(H2CO3)•Ka2(H2CO3)<KW,故B正确;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),故C错误;
D.任何电解质溶液中都存在物料守恒,未加NaOH时,根据物料守恒c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-),加入NaOH溶液时则存在c(Na+)>c(H2CO3)+c(HCO3-)+c(CO32-),故D错误;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生分析判断能力,明确溶液中溶质及其性质是解本题关键,注意结合电荷守恒、物料守恒判断,易错选项是B,注意等量代换,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 在同一个电子层上运动的电子,其自旋方向肯定不同 | |
| B. | 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 | |
| C. | 物质的键能越大,该物质本身具有的能量越低 | |
| D. | 在周期表中原子的族序数等于它的最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应在任何情况下均能自发进行 | |
| B. | 该反应在任何情况下均不能自发进行 | |
| C. | 该反应在一定条件下能自发进行 | |
| D. | 条件不足,无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某芳香烃的分子式为C10H14,不能使溴水因反应而褪色,苯环上只有一个取代基,符合条件的烃有4种 | |
| B. | 按照系统命名法,有机物 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 | |
| C. | 甲烷、甲醛、甲酸甲脂都不存在同分异构体 | |
| D. | 某有机物含有C、H、O、N四种元素,其球棍模型为 该有机物能发生取代反应 该有机物能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
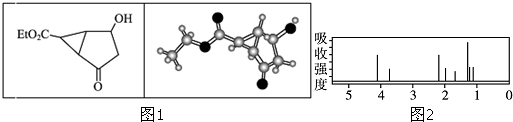
| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 利用质谱法不能确定该有机物的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| V(M)(x10-3mol.L-1.min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | CH3COOH | H | HNO |
| 电离常数(25℃) | K=1.8×10-5 | K=4.×10-7 K=5.6×10-11 | K=5.0×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1的氨水溶液中c(OH-)=0.01 mol•L-1 | |
| B. | 常温下,将pH为12的氨水溶液加水稀释100倍,稀释后的溶液pH大于10 | |
| C. | 10 mL 1 mol•L-1的氨水溶液恰好与10 mL 1 mol•L-1的盐酸完全反应 | |
| D. | 在相同条件下,氨水溶液的导电性比NaOH溶液弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该温度下,0.0l mol/L醋酸溶液的pH=4 | |
| B. | 该温度下,用0.1 mol/L醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1:10 | |
| C. | 该温度下,0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH<4.7 | |
| D. | 该温度下,0.2 mol/L盐酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH>4.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com