
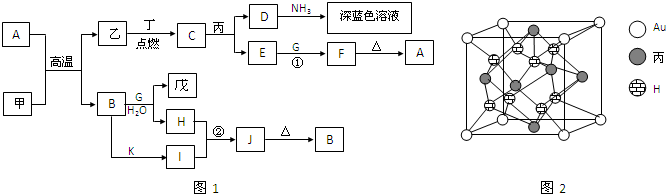
化合物A为一种常见金属元素与一种常见非金属元素组成的化合物,阳离子与阴离子的个数比为2:3。K为常见固态非金属单质,J为常见气态单质。其余为化合物,其中I、F在常温下为液态,C、D为刺激性气体,H无色无味气体,B为白色胶状沉淀,L为氯碱工业中的常见产品。F的浓溶液与K加热可生成D和H。(部分生成物未标出)

(1)写出H的电子式
(2)写出下列物质的化学式:
E J
(3)写出下列变化的化学方程式:
A + I → B + C
F的浓溶液与K加热可生成D和H
(4)写出下列变化的离子方程式:
B中加入L的水溶液
G的水溶液中通入过量的H
(1)![]() (2分) (2)SO3(2分) O2(2分)
(2分) (2)SO3(2分) O2(2分)
(3)Al2S3 + 6H2O == 2Al(OH)3 + 3H2S↑ (2分) C + 2H2SO4 == CO2↑ + 2SO2↑ + 2H2O(2分)
(4)Al(OH)3 + OH- == AlO2- + 2H2O (2分) AlO2- + CO2 + H2O == Al(OH)3 + HCO3-(2分)
该无机推断的突破口是:F的浓溶液与常见固态非金属单质K加热可生成刺激性气体D和无色无味气体H。中学里符合该反应的只有碳跟浓硫酸或与浓硝酸反应,而根据关系图,只有浓硫酸符合图中的物质间转化。另外,白色胶状沉淀一般为氢氧化铝,液态化合物I一般为水。综合这些信息,可以推测A为一种Al与S![]() 组成的化合物,根据阳离子与阴离子的个数比为2:3,即可得知A为Al2S3。
组成的化合物,根据阳离子与阴离子的个数比为2:3,即可得知A为Al2S3。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:阅读理解




查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省临沂市高三上学期期中考试化学试卷(解析版) 题型:填空题
四种短周期元素X、Y、Z、W,原子序数依次增大,请结合表中信息回答下列问题。

(1)W元素在周期表的位置为______________。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质与其它三种物质在一定条件下均能发生化学反应,该元素是_________(填元素名称)。
(3)X元素的最高价氧化物对应的水化物与其气态氢化物反应得到的化合物为___________(填化学式)。
(4)向含有Z元素的简单阳离子的溶液中加入过量的NaOH溶液,发生反应的离子方程式为_____________________________________。
(5)下列可作为比较Z和Mg金属性强弱的方法是_______(填代号)。
a.测两种元素单质的硬度和熔、沸点
b.测等浓度相应氯化物水溶液的pH
c.比较单质与同浓度盐酸反应的剧烈程度
d.比较两种元素在化合物中化合价的高低
(6)Z单质和Mg组成的混合物是一种常见的焰火材料,某化学兴趣小组设计了如下图所示的实验方案,测定该混合物中Z的质量分数。

能确定混合物中Z的质量分数的数据组有_________(填代号)。
a. b.
b. c.
c.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com