
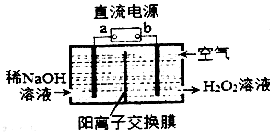
 H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示:
H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示:科目:高中化学 来源: 题型:解答题
 在容积为2L的密闭容器中,投入2molA和3molB发生反应:A(s)+2B(g)?2C(g),B的物质的量的变化如图所示.已知:2~t1时段的正反应速率比t2~t3时段的正反应速率快.
在容积为2L的密闭容器中,投入2molA和3molB发生反应:A(s)+2B(g)?2C(g),B的物质的量的变化如图所示.已知:2~t1时段的正反应速率比t2~t3时段的正反应速率快.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 交换膜Ⅰ为阴离子交换膜,A-从浓缩室通过向阳极移动 | |
| B. | 交换膜Ⅱ为阴离子交换膜,H+从浓缩室通过向阴极移动 | |
| C. | 阳极的电极反应式为2H2O-4e-═4H++O2↑ | |
| D. | 400mL0.1mol•L-1乳酸溶液通电一段时间后,浓度上升到0.6mol•L-1,则阴极上产生的H2在标准状况下的体积为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3 | |
| B. | 若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2 | |
| C. | 若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3 | |
| D. | 若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z、W、Q、X、Y原子半径依次减小 | |
| B. | W最高价氧化物对应水化物一定能溶于Z最高价氧化物对应水化物的溶液中 | |
| C. | Y与Q形成化合物在常温下一定为气态 | |
| D. | Z、Q元素的单质都可以将X元素的单质从其氧化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )| A. | 溶液中H+的移动方向由A极到B极 | |
| B. | 电池总反应方程式为:2SO2+O2+2H2O=2H2SO4 | |
| C. | 正极电极反应式为:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 当有0.25mol SO2被吸收时,通过H+交换膜的H+的物质的量为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
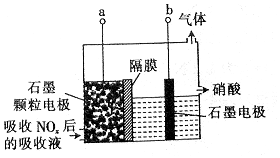
| A. | 吸收NOx的过程涉及氧化还原反应 | |
| B. | 石墨电极为颗粒状,可增大接触面积,提高电解效率 | |
| C. | 当b极上产生2.8 L(标准状况)H2时,转移的电子数为0.5NA(设NA为阿伏加德罗常数的数值) | |
| D. | a极的电极反应式为HNO2-2e-+H2O═3H++NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子从b流出,经外电路流向a | |
| B. | HS在硫氧化菌作用下转化为SO42-的反应是HS-+4H2O-8e-═SO42-+9H+ | |
| C. | 如果将反应物直接燃烧,能量的利用率不会变化 | |
| D. | 若该电池电路中有0.4mol电子发生转移,则有0.5mol H+通过质子交换膜 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:填空题
(1)相同物质的量的O2和O3的质量比为___________。
(2)2.5 mol Ba(OH)2中含有__________个OH—,2.5 mol Ba(OH)2的质量是___________g。
(3)在标准状况下,1.7 g氨气所占的体积约为___________L,它与标准状况____________L硫化氢含有相同数目的氢原子。
(4)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为_____________。
(5)同温同压下,SO2与氦气的密度之比为___________,若质量相同,两种气体的体积比为___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com