有A、B、C、D、E五种短周期元素,已知A是构成化合物种类最多的元素,其原子最外层电子数是次外层电子数的2倍;E的最高正价和最低负价代数和为4;C与E同主族;B与D同主族;D+与氖原子具有相同的电子层结构;B元素原子的电子层数与族序数相等.试回答:
(1)元素符号:A ;B ;E ;
(2)写出C在元素周期表中的位置 ;
(3)C、D、E原子半径由大到小的顺序是: ;(用元素符号表示)
(4)写出AC2的电子式: ; B、C、D所形成的化合物的电子式 ,并写出所含化学键的类型 ;
(5)写出A和D两种元素的最高价氧化物发生氧化还原反应的化学方程式: .
【答案】
分析:A是构成化合物种类最多的元素,其原子最外层电子数是次外层电子数的2倍,应为C元素,E的最高正价和最低负价代数和为4,则E为S元素,C与E同主族,应为O元素,D
+与氖原子具有相同的电子层结构,则原子核外各层电子数分别为2、8、1,应为Na元素,B与D同主族,B元素原子的电子层数与族序数相等,应为H元素,从原子核外电子排布特点推断元素在周期表中的位置,结合元素周期律的递变规律比较原子半径大小,并书写电子式以及对应化合物的性质.
解答:解:(1)A是构成化合物种类最多的元素,其原子最外层电子数是次外层电子数的2倍,应为C元素,E的最高正价和最低负价代数和为4,则E为S元素,C与E同主族,应为O元素,D
+与氖原子具有相同的电子层结构,则原子核外各层电子数分别为2、8、1,应为Na元素,B与D同主族,B元素原子的电子层数与族序数相等,应为H元素,
故答案为:C;H;S;
(2)C为O元素,原子核外有2个电子层,最外层电子数为6,则应位于第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(3)C为O元素,D为Na元素,E为S元素,Na与S位于同周期,同周期元素从左到右原子半径逐渐减小,则原子半径Na>S,
S比O元素多一个电子层,电子层数越多,半径越大,则半径S>O,所以原子半径Na>S>O,故答案为:Na>S>O;
(4)AC
2对应的化合物为CO
2,为共价化合物,电子式为
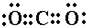
,B、C、D所形成的化合物为NaOH,为离子化合物,电子式为

,含有离子键和极性共价键,
故答案为:

;

;离子键和极性共价键;
(5)A和D两种元素的最高价氧化物分别为CO
2、Na
2O
2或Na
2O,能发生氧化还原反应的为CO
2和Na
2O
2,反应的化学方程式为2Na
2O
2+2CO
2=2Na
2CO
3+O
2,
故答案为:2Na
2O
2+2CO
2=2Na
2CO
3+O
2.
点评:本题考查元素位置结构性质的相互关系应用问题,题目难度中等,本题中元素的推断为解答题目的关键,学习中注意把握电子式的书写以及化学键的特点.

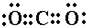 ,B、C、D所形成的化合物为NaOH,为离子化合物,电子式为
,B、C、D所形成的化合物为NaOH,为离子化合物,电子式为 ,含有离子键和极性共价键,
,含有离子键和极性共价键, ;
; ;离子键和极性共价键;
;离子键和极性共价键;

 一线名师提优试卷系列答案
一线名师提优试卷系列答案










