
 将0.1mol的镁铝混合物溶于100mL 4mol?L-1 HCl溶液中,然后滴加1mol?L-1的NaOH溶液.请回答:若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液体积(V)的变化如图所示:
将0.1mol的镁铝混合物溶于100mL 4mol?L-1 HCl溶液中,然后滴加1mol?L-1的NaOH溶液.请回答:若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液体积(V)的变化如图所示:
|
| 0.46mol |
| 1mol/L |


科目:高中化学 来源: 题型:
| A、MgO、Al2O3、SO2、CO2 |
| B、CO2、Cl2、CaO、SO3 |
| C、Cl2、Al2O3、N2O3、SO3 |
| D、SiO2、N2O5、CO、Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方法步骤 | 现象 | 结论 |
| 取少量粉末加入足量稀硫酸 | 假设1成立 | |
| 假设2成立 | ||
| 假设3成立 |
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
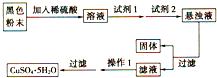 若经过实验分析确定,该黑色物质为氧化铜和氧化亚铁的混合物,实验小组欲利用该黑色粉末制取较纯净的硫酸铜,设计如图实验方案,则回答:试剂1是
若经过实验分析确定,该黑色物质为氧化铜和氧化亚铁的混合物,实验小组欲利用该黑色粉末制取较纯净的硫酸铜,设计如图实验方案,则回答:试剂1是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2O3加到热水中 |
| B、向NaAlO2溶液中加入过量盐酸 |
| C、将Na投入到NaAlO2溶液中 |
| D、在AlCl3溶液中滴几滴NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠溶液 |
| B、氢氧化钡溶液 |
| C、氨水 |
| D、澄清的石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:

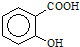 )可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式
)可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C8H5NO |
| B、C2H2NO |
| C、C4H6NO |
| D、C7H8NO |
查看答案和解析>>
科目:高中化学 来源: 题型:
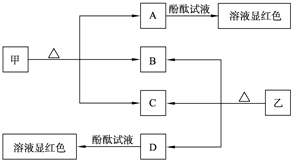
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大理石雕像被酸雨腐蚀毁坏 |
| B、充有氢气的气球遇明火爆炸 |
| C、铁制菜刀生锈 |
| D、铜铸塑像上出现铜绿[Cu2 (OH)2CO3] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com