

分析 (1)由图可知,反应物的总能量大于生成物的总能量;
(2)结合平衡的特征“等、定”及衍生的物理量判断;
(3)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始 1 3 0 0
转化 0.75 2.25 0.75 0.75
平衡 0.25 0.75 0.75 0.75
结合v=$\frac{△c}{△t}$、物质的量比等于压强比计算;
(4)甲醇、氧气在酸性条件下可构成燃料电池,负极上甲醇失去电子生成二氧化碳;铅蓄电池中负极材料为Pb,氧化为PbSO4,结合电子转移守恒计算甲醇燃料电池的理论放电量与铅蓄电池的倍数.
解答 解:(1)由图可知,该反应中反应物的总能量大于生成物的总能量,则该反应为放热反应,
故答案为:放;反应物的总能量高于生成物的总能量;
(2)A.v (H2)=3v(CO2),始终存在,不能判断正逆反应速率关系,不能判定平衡状态,故A不选;
B.该反应为气体体积不等的反应,则容器内气体压强保持不变,达到平衡状态,故B选;
C.v逆(CO2)=v正(CH3OH),可知正逆反应速率相等,能判定平衡状态,故C选;
D.混合气体的质量、体积不变,则容器内气体密度始终保持不变,不能判定平衡状态,故D不选;
E.1mol H-O键断裂的同时2mol C=O键断裂,可知正逆反应速率相等,能判定平衡状态,故E选;
故答案为:BCE;
(3)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始 1 3 0 0
转化 0.75 2.25 0.75 0.75
平衡 0.25 0.75 0.75 0.75
从反应开始到平衡,用氢气浓度变化表示的平均反应速率为:v (H2)=$\frac{2.25mol/L}{10min}$=0.225mol/(L.min); 达平衡时容器内平衡时与起始时的压强之比为:$\frac{0.25+0.75+0.75+0.75}{1+3}$=5:8 (或0.625),
故答案为:0.225mol/(L.min); 5:8 (或0.625);
(4)甲醇、氧气在酸性条件下可构成燃料电池,其负极的电极反应式为CH3OH-6e-+H2O=6H++CO2;铅蓄电池中负极材料为Pb,氧化为PbSO4,甲醇燃料电池中负极通入甲醇,氧化生成CO2,相同质量提供电子数目之比为:$\frac{1}{207}$×2:$\frac{1}{32}$×6=32:621,则甲醇燃料电池的理论放电量是铅蓄电池的$\frac{621}{32}$=19.4倍,
故答案为:CH3OH-6e-+H2O=6H++CO2; 19.4.
点评 本题考查化学平衡计算、平衡判定、反应热与焓变及原电池,为高频考点,把握化学平衡三段法、反应中能量变化、电极反应书写为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:解答题
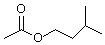 )是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:
)是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.钢铁发生吸氧腐蚀的正极反应式:O2+4e-+2H2O=4OH-
D.用铁作电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示对应的装置合理、操作规范的是
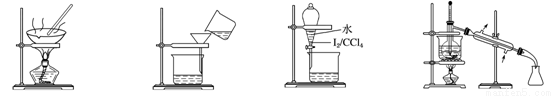
A.灼烧 B.过滤 C.分液 D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| 1 | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | a | $\frac{1}{3}$ | 5 |
| 3 | 350 | b | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | N≡N | H-O | O-O | H-N |
| E/kJ•mol-1 | a | b | c | d |
| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| N(SO2) | N(NO2) | N(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
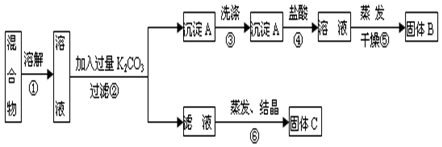
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
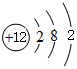 ,⑤
,⑤ .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com