

分析 A中碳的质量分数为44.1%,氢的质量分数为8.82%,则A中氧的质量分数为1-44.1%-8.82%=47.08%.由此可算出C:H:O=5:12:4,分子式为C5H12O4,A能与钠反应且分子中只含一种含氧官能团,该官能团必为羟基.含有2种不同化学环境的氢原子且原子个数比为2:1,其结构为C(CH2OH)4,结合有机物对应官能团的性质解答该题.
解答 解:由于A中碳的质量分数为44.1%,氢的质量分数为8.82%,故A中氧的质量分数为1-44.1%-8.82%=47.08%.由此可算出C:H:O=$\frac{44.1%}{12}$:$\frac{8.82%}{1}$:$\frac{47.08%}{16}$=5:12:4,则分子式为C5H12O4,A能与钠反应且分子中只含一种含氧官能团,该官能团必为羟基.含有2种不同化学环境的氢原子且原子个数比为2:1,其结构为C(CH2OH)4,
(1)由以上分析可知A的分子式为C5H12O4,结构简式为C(CH2OH)4;
故答案为:C5H12O4;C(CH2OH)4;
(2)A为C(CH2OH)4,含有羟基,可发生取代、氧化反应,因相邻碳原子没有H原子,不能够发生消去反应,为饱和醇,不能发生加成反应,
故答案为:AC;
(3)所有满足下列三个条件的A的同分异构体的结构简式为: ,
,
故答案为:
点评 本题考查有机物的推断,侧重考查有机物分子式、结构简式的确定以及有机物官能团的结构与性质,题目难度中等,注意掌握确定有机物分子式的常用方法,(3)为易错点,注意掌握同分异构体的书写原则.


科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7mol•L-1 | |
| B. | 0.1mol•L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 0.1mol•L-1pH=4的NaHC2O4溶液:c(H2C2O4)>c(C2O42-) | |
| D. | 向1.0L0.1mol•L-1的醋酸钠溶液中加入1.0L0.1mol•L-1盐酸:c(Na+)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O>H2Te>H2Se>H2S | B. | HF>HI>HBr>HCl | ||
| C. | SbH3>NH3>AsH3>PH3 | D. | H2O>NH3>HF>CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极反应为:PbO2+4H++2e-=Pb2++2H2O | |
| B. | 充电时,当阳极质量增加23.9g时转移0.4mol电子 | |
| C. | 放电时,正极区电解质溶液的pH增大 | |
| D. | 充电时,Pb电极与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
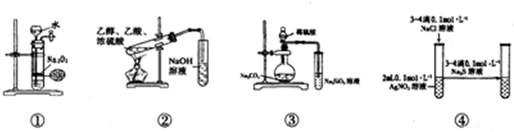
| A. | 装置①可制备少量氧气 | |
| B. | 装置②可用于实验室制取和收集乙酸乙酯 | |
| C. | 装置③的实验可推断硫、碳、硅三种元素的非金属强弱 | |
| D. | 装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体加入适量的稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液 | 若溶液不变红,则假设一成立,若溶液变红,则假设一不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 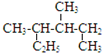 的系统命名是2,3-二甲基戊烷 的系统命名是2,3-二甲基戊烷 | |
| B. | 向鸡蛋清溶液中分别加入(NH4)2SO4和CuSO4溶液都能使鸡蛋清聚沉,其作用原理相同 | |
| C. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与足量的氢气充分反应后的产物也不是同系物 | |
| D. | 等物质的量的乙炔、乙醛、(HO)CH2-CH2(OH)完全燃烧时的耗氧量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.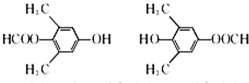 .
.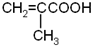 )的合成路线:
)的合成路线: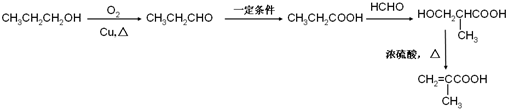 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com