
| A. | 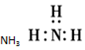 | B. | 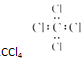 | C. | 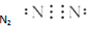 | D. | 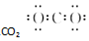 |
分析 A.氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子;
B.氮气分子中存在氮氮三键,氮原子最外层为8电子;
C.四氯化碳的电子式中漏掉了每个氯原子的3对孤电子对;
D.二氧化碳分子中每个氧原子和碳原子形成两个共用电子对,每个氧原子含有2个孤电子对.
解答 解:A.氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子,氨气分子的电子式为 ,故A错误;
,故A错误;
B.四氯化碳分子中含有4个碳氯键,碳原子和氯原子最外层达到8电子稳定结构,四氯化碳正确的电子式为: ,故B错误;
,故B错误;
C.氮气分子中存在氮氮三键,氮原子最外层为8电子,故N2的电子式为 ,故C正确;
,故C正确;
D.二氧化碳分子中每个氧原子和碳原子形成两个共用电子对,每个氧原子含有2个孤电子对,二氧化碳分子的电子式为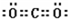 ,故D错误;
,故D错误;
故选C.
点评 本题考查电子式的书写,题目难度不大,注意电子式中的电子数是指最外层电子数,而不是指电子总数,阴离子要写出离子的电子分布并加上括号和电荷.


科目:高中化学 来源: 题型:选择题
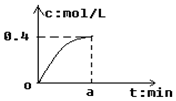 反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 5 | B. | 2.5 | C. | 7.5 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2MnO2+2NH4++2e-═2MnO(OH)+2NH3 | B. | Zn-2e-═Zn2+ | ||
| C. | [Zn(NH3)2]2++2e-═Zn+2NH3 | D. | Mn4++e-═Mn3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 70 mL | B. | 60mL | C. | 80 mL | D. | 128 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始时观察到金属碎片表面有极少量气泡,可能原因为该金属片表面有氧化膜 | |
| B. | 过程中观察到金属碎片表面有大量气泡并在液面上“翻滚”,说明该合金碎片的密度小于该盐酸溶液的密度 | |
| C. | 该盐酸的物质的量浓度一定为4.0 mol•L-1 | |
| D. | 溶液X中Mg2+与Al3+的物质的量之比一定为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
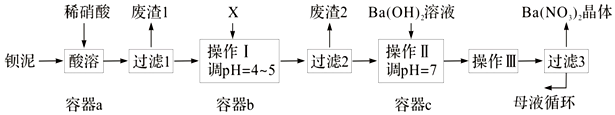
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
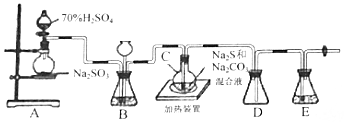
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com