
【题目】二甲醚(CH3OCH3)是一种气体麻醉剂,可由“可燃冰”为原料合成。回答下列问题:
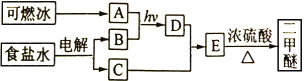
(1)B为黄绿色气体,其化学名称为____________。
(2)由A和B生成D的化学方程式为__________________。
(3)E的结构简式为____________。
(4)由E生成二甲醚的反应类型为______________________。
(5)二甲醚的同分异构体的结构简式为_____________。
【答案】氯气 CH4+Cl2![]() CH3Cl+HCl CH3OH 取代反应 CH3CH2OH
CH3Cl+HCl CH3OH 取代反应 CH3CH2OH
【解析】
可燃冰的主要成分A是甲烷,电解食盐水得到氢氧化钠、氢气和氯气,由图反应关系可确定B为氯气,C为氢氧化钠。D为一氯甲烷,一氯甲烷在碱性条件下水解生成甲醇,甲醇在浓硫酸加热的条件下分子间脱水生成二甲醚。
根据以上分析,A为甲烷,B为氯气,C为氢氧化钠,D为一氯甲烷,E为甲醇,
(1)B为黄绿色气体,其化学名称为氯气。
故答案为:氯气。
(2)由A和B生成D的反应为甲烷和氯气在光照条件下生成一氯甲烷的反应,反应方程式为CH4+Cl2![]() CH3Cl+HCl。
CH3Cl+HCl。
故答案为:CH4+Cl2![]() CH3Cl+HCl。
CH3Cl+HCl。
(3)E为甲醇,结构简式为CH3OH。
故答案为:CH3OH。
(4)由E生成二甲醚的反应为甲醇的分子间脱水,类型为取代反应。
故答案为:取代反应。
(5)二甲醚的分子式为C2H6O,同分异构体是乙醇,结构简式为CH3CH2OH。
故答案为:CH3CH2OH。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3·5H2O),又名大苏打、海波,主要用于照相业作定影剂、作鞣革时重铬酸盐的还原剂,易溶于水,遇酸易分解。其工艺制备流程如下:
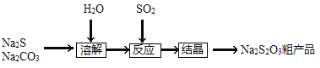
某化学兴趣小组同学模拟该流程设计了如下实验装置:
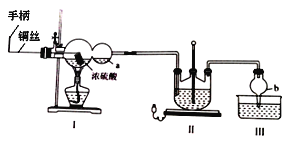
回答下列问题:
(1)双球管a处的液体可用来检验I中的反应是否发生,选用的试剂是______(填字母)
a、品红溶液 b、NaOH溶液 c、稀硫酸
若要停止I中的化学反应,除停止加热外,还要采取的操作是___________________。
(2)加热I,使反应完全,发现浸入液面下的铜丝变黑,甲同学对黑色生成物提出如下假设:①可能是Cu2O;②可能是CuO;③可能是CuS;④CuS和CuO的混合物。乙同学提出假设①一定不成立,该同学的依据是____________________________________;丙同学做了如下实验来验证黑色物质的组成:

基于上述假设分析,原黑色物质的组成为____________________(填化学式)。
(3)II中发生反应的化学方程式为_____________________,实验中通入的SO2不能过量,可能的原因是______________________________________________________。
(4)丁同学提出上述实验装置的设计存在不足,建议在I上_____________;在I、II之间增加_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为__________________。
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该过程的离子方程式____________。配制的FeCl3溶液应保持_______(填“酸性”“碱性”或“中性”),原因是_____________。
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I―=2CuI↓+I3- ②I3- +2S2O32-=3I―+2S2O62-
反应①中的氧化剂为_____________。现取20.00 mL含Cu2+的溶液,加入足量KI充分反应后,用0.1000 mol·L1 Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00 mL,此溶液中Cu2+的浓度为_______mol·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如下图所示。下列有关该有机物说法正确的是
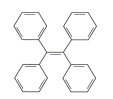
A. 分子式为C26H22 B. 属于苯的同系物
C. 一氯代物有3种 D. 能溶于水和酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组查阅资料了解到以下内容:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为___________________________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_____________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4–+ ____ H2C2O4+ ____ H+ ![]() ____ Mn2++ ____CO2↑ + ____ H2O
____ Mn2++ ____CO2↑ + ____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(注:忽略草酸的升华,且夹持装置未标出):
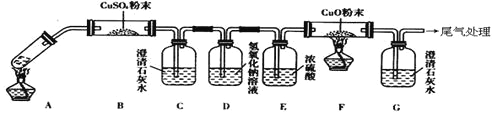
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末由黑色变为红色。据此回答:
上述装置中,D的作用是__________________.乙二酸分解的化学方程式为______________________________________.
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是______________________(用文字简单表述)。
(5)以上溶液中各离子的浓度由大到小的顺序为_________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由铜、锌和稀盐酸组成的原电池中,铜是________极,发生________反应,电极反应式是________;锌是________极,发生________反应,电极反应式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com