
| c2(CO) |
| c(CO2) |
| 0.22 |
| 0.05 |
| 14g |
| 25g |
| 6.4g |
| 64g/mol |


科目:高中化学 来源: 题型:
| A、生物质能来源于植物及其加工产品贮存的能量,不包括农业废弃物、动物粪便等 |
| B、密闭容器可逆反应N2+3H2?2NH3达到平衡后,增加氮气,氢气的转化率一定增大 |
| C、平衡常数发生变化,化学平衡必定发生移动,达到新平衡 |
| D、废弃的电池、金属制品属于不可回收再利用的资源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属与盐溶液间的反应一定是置换反应 | ||||
| B、能与酸反应的氧化物一定是碱性氧化物 | ||||
C、
| ||||
| D、常见金属铁和铝在工业上是由热还原法制得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
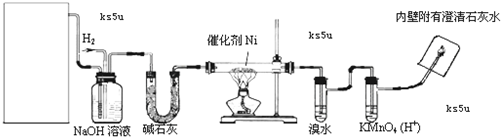
查看答案和解析>>
科目:高中化学 来源: 题型:
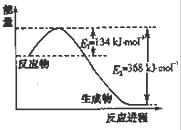
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com