
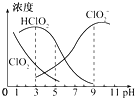
 亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用 但ClO2是有毒的气体,25℃时各离子浓度随pH变化如图所示下列分析错误的是( )
亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用 但ClO2是有毒的气体,25℃时各离子浓度随pH变化如图所示下列分析错误的是( )| A. | 25℃时HClO2的电离平衡常数Ka=10-6 | |
| B. | 使用漂白剂的最佳pH为3 | |
| C. | 25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合混合溶液中c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) | |
| D. | 25℃时 用0.1000mol/LNaOH溶液滴定20.00ml某未知浓度的HClO2溶液 当滴入NaOH溶液体积为20.00ml时溶液呈中性 则HClO2溶液的实际浓度为0.11mol/L |
分析 A.由图可知,亚氯酸与亚氯酸根离子浓度相等时,溶液的pH=6,据此计算出亚氯酸的电离平衡常数,HClO2的电离平衡常数K=$\frac{[{H}^{+}][Cl{{O}_{2}}^{-}]}{[HCl{O}_{2}]}$结合图示数据来计算;
B.根据题意:HClO2和ClO2都具有漂白作用,结合图中HClO2和ClO2的浓度大小来确定使用该漂白剂的最佳pH;
C.依据电中性原则得出:c(H+)+c(Na+)=c(ClO2-)+c(OH-),依据物料守恒得出:2c(Na+)=c(ClO2-)+c(HClO2),据此计算解答即可.
D.依据电中性原则得出:c(H+)+c(Na+)=c(ClO2-)+c(OH-),c(Na+)=c(ClO2-)反应后得到溶液中为HClO2溶液和NaClO2的混合溶液,结合平衡常数计算HClO2平衡浓度和混合后的HClO2的起始浓度,原溶液等体积混合,得到和碱混合前HClO2溶液的实际浓度等于混合后的HClO2的起始浓度的2倍;
解答 解:A.由图可知,当溶液的pH=6时,溶液中c(ClO2-)=c(HClO2),HClO2的电离平衡常数K=$\frac{[{H}^{+}][Cl{{O}_{2}}^{-}]}{[HCl{O}_{2}]}$=10-6,故A正确;
B.HClO2是漂白织物的有效成分,ClO2是有毒气体,要使漂白剂的漂白性强,即HClO2的含量高,又要使ClO2浓度较小,根据图象知,pH过小,ClO2含量较大,pH过大,HClO2的含量较低,当溶液的pH为4.0~4.5时二者兼顾,即为使用该漂白剂的最佳pH,应该是4-5,故B错误;
C.依据电中性原则得出:c(H+)+c(Na+)=c(ClO2-)+c(OH-) ①,依据物料守恒得出:2c(Na+)=c(ClO2-)+c(HClO2) ②,联立①②消去钠离子:c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-),故C正确,
D.25℃时 用0.1000mol/LNaOH溶液滴定20.00ml某未知浓度的HClO2溶液 当滴入NaOH溶液体积为20.00ml时溶液呈中性,c(H+)=c(OH-)=10-7mol/L,溶液中存在电荷守恒得到:c(H+)+c(Na+)=c(ClO2-)+c(OH-),c(Na+)=c(ClO2-)=0.05mol/L,混合后的溶液中HClO2的平衡常数K=$\frac{[{H}^{+}][Cl{{O}_{2}}^{-}]}{[HCl{O}_{2}]}$=$\frac{1{0}^{-7}×0.05}{[HCl{O}_{2}]}$=10-6,得到[HClO2]=5×10-3mol/L,混合后HClO2的起始浓度c(HClO2)=5×10-3mol/L+0.05mol/L=0.055mol/L,原溶液等体积混合,则和碱混合前HClO2溶液的实际浓度等于混合后的HClO2的起始浓度的2倍=0.055mol/L×2=0.11mol/L,故D正确;
故选B.
点评 本题考查了酸碱混合的定性判断,题目难度稍大,正确分析、理解题中信息及图象数据是解答本题关键,注意明确溶液酸碱性与溶液pH的关系.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有②③ | B. | 只有①②③ | C. | 只有①③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用废弃动植物油脂与低碳醇通过酯交换反应制成生物柴油来代替柴油作为机车燃料,这种做法符合“绿色化学”理念 | |
| B. | 生物炼铜是利用生物质能转化为化学能的原理实现的 | |
| C. | 元素分析仪不但可以检测物质中的许多非金属元素,也可以检测金属元素 | |
| D. | 霾是悬浮在大气中的大量微小尘粒、烟粒或盐粒的集合体,霾的形成与PM2.5有直接关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
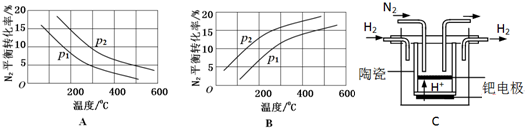
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
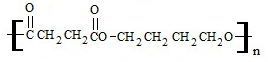 +2nH2O.
+2nH2O. 的合成路线.(无机试剂可以任选)
的合成路线.(无机试剂可以任选)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 学习化学应该明确“从生活中来,到生活中去”的道理.
学习化学应该明确“从生活中来,到生活中去”的道理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、BaCl2 | B. | HCl、KNO3 | C. | HCl、Na2CO3 | D. | Na2CO3、KNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com