
| A. | 2KMnO4+H2O2+3H2SO4═K2SO4+2MnSO4+3O2↑+4H2O | |
| B. | 2KMnO4+3H2O2+3H2SO4═K2SO4+2MnSO4+4O2↑+6H2O | |
| C. | 2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H2O | |
| D. | 8KMnO4+2H2O2+12H2SO4═4K2SO4+8MnSO4+11O2↑+14H2O |
分析 过氧化氢与高锰酸钾在酸性环境下发生氧化还原反应,过氧化氢被氧化为氧气,高锰酸钾被还原为二价锰离子,依据氧化还原反应得失电子守恒,原子个数守恒判断解答.
解答 解:高锰酸钾与过氧化氢发生氧化还原反应,锰元素化合价变化:+7~+2价,过氧化氢中氧元素化合价变化:-1~-2价,依据氧化还原反应得失电子守恒,最小公倍数为10,则高锰酸钾系数为2,过氧化氢系数为5,依据原子个数守恒反应的化学方程式:2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H2O,
故选:C.
点评 本题考查了化学方程式的书写,侧重考查氧化还原反应方程式书写考查,明确氧化还原反应得失电子守恒、原子个数守恒规律是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 任何条件下,反应2CO2(g)═2CO(g)+O2(g)均不能自发进行 | |
| B. | 依据反应I2+2S2O32-═2I-+S4O62-,若要测定平衡体系I2+I-?I3-中平衡时的 c(I2),可用已知物质的量浓度的Na2S2O3溶液进行滴定实验 | |
| C. | 向含有苯酚的苯溶液中滴入少量浓溴水未见白色沉淀,是因为生成的三溴苯酚又溶于苯中 | |
| D. | 检验某物质是否含有Fe2O3的操作步骤是:样品粉碎→加水溶解→过滤,向滤液中滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 微粒组 | 所加试剂 | 离子方程式 |
| A | NH4+、Mg2+、SO42- | 少量Ba(OH)2溶液 | NH4++SO42-+Ba2++OH-=BaSO4↓+NH3•H2O |
| B | Mg2+、HCO3-、Cl- | 过量NaOH溶液 | Mg2++2HCO3-+2OH-=MgCO3-↓+CO32-+2H2O |
| C | H+、Na+、NO3- | Fe粉 | Fe+2H+=Fe2++H2↑ |
| D | Ca2+、NH3•H2O、Cl- | 通入过量CO2 | NH3•H2O+CO2=NH4++HCO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑦ | B. | 除⑤⑥外 | C. | ②③⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,FeS,ZnS、CuS的溶解度依次增大 | |
| B. | ZnS饱和溶液中加入少量NazS固体,平衡后溶液中c(Zn2+)•c(S2-)=Ksp(ZnS),c(Zn2+)=c(S2-) | |
| C. | 除去工业废水中的Cu2+,可用FeS作为沉淀剂 | |
| D. | 某溶液中含有Fe2+、Cu2+和Znz+,浓度均为0.010 moI•L-1.向该溶液中逐滴加入0.010 mol•L-1的Na2S溶液时,Fe2+最先沉淀出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
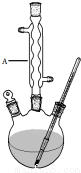 水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(结构简式为
水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(结构简式为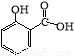 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com