

分析 (1)根据影响化学反应速率的因素判断,一般增大浓度、增大压强、升高温度,反应的反应速率增大;
(2)根据元素守恒和电子得失守恒写出化学方程式;
(3)根据元素守恒及题中的反应物和生成物写出化学方程式,在CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池中,负极上CH3CH2OH失去电子,发生氧化反应,可写出电极反应式;
(4)根据化学方程式,利用元素守恒,可计算出尿素的质量.
解答 解:(1)根据影响化学反应速率的因素可知,升高温度和加入催化剂都可以增加反应速率,充入氦气各物质的浓度没变,所以反应速率不变,减小压强反应速率减小,
故答案为:ac;
(2)根据元素守恒及题中的反应物和生成物可知化学方程式为:2NH4HS+O2 $\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S↓,
故答案为:2NH4HS+O2 $\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S↓;
(3)根据元素守恒及题中的反应物和生成物写出化学方程式为:2CO2+6H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CH3CH2OH+3H2O,在CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池中,负极上CH3CH2OH失去电子,发生氧化反应,可写出电极反应式为CH3CH2OH-12e-+16OH-═2CO32-+11 H2O,
故答案为:2CO2+6H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CH3CH2OH+3H2O;CH3CH2OH-12e-+16OH-═2CO32-+11 H2O;
(4)根据元素守恒及题中的反(5)根据化学方程式CH4(g)+H2O(g)?CO(g)+3H2(g) 和 CO(g)+H2O(g)?CO2(g)+H2(g),CO2+2NH3 $\frac{\underline{\;一定条件\;}}{\;}$CO(NH2)2+H2O,及元素守恒可知CH4~4H2 ~$\frac{8}{3}$NH3~$\frac{4}{3}$CO(NH2)2,
根据CH4~4H2 ~$\frac{8}{3}$NH3~$\frac{4}{3}$CO(NH2)2
16 80
100t×80% xt
x=$\frac{80×100×80%}{16}$t=400t
故答案为:400.
点评 本题主要考查了影响化学反应速率因素、化学方程式的书写、根据化学方程式的计算等知识,有一定的综合性,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 浊液a中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) | |
| B. | 滤液b中不含有Ag+ | |
| C. | ③中颜色变化说明AgCl转化为AgI | |
| D. | 实验可以证明AgI比AgCl更难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
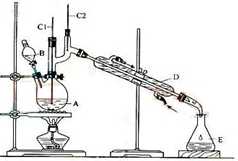 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
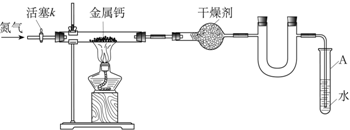
| 空硬玻璃管质量m0/g | 硬玻璃管与钙的质量m1/g | 硬玻璃管与产物的质量m2/g |
| 114.8 | 120.8 | 122.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
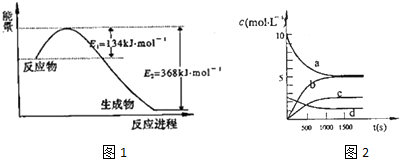
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com