
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A. 反应在前50 s的平均速率为v(PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应的△H<0
C. 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率小于80%
【答案】C
【解析】A、由表中数据可知50s内,△n(PCl3)=0.16mol,v(PCl3)= =0.0016mol/(Ls),故A错误;B、由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.22mol,根据平衡时n(PCl3),判断平衡移动方向,升高温度平衡向吸热反应方向移动,△H>0,故B错误;
=0.0016mol/(Ls),故A错误;B、由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.22mol,根据平衡时n(PCl3),判断平衡移动方向,升高温度平衡向吸热反应方向移动,△H>0,故B错误;
C、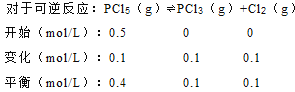 ,所以平衡常数k=
,所以平衡常数k=![]() ,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,起始时PCl5的浓度为0.5mol/L、PCl3的浓度为0.1mol/L、Cl2的浓度为0.1mol/L,浓度商Qc=
,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,起始时PCl5的浓度为0.5mol/L、PCl3的浓度为0.1mol/L、Cl2的浓度为0.1mol/L,浓度商Qc=![]() ,,Qc<K,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),故C正确;D、等效为起始加入2.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于0.4mol,即相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的物质的量小于0.4mol,参加反应的PCl3的物质的量大于1.6mol,故达到平衡时,PCl3的转化率高于1.6mol/2mol=0.8,故D错误;故选C。
,,Qc<K,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),故C正确;D、等效为起始加入2.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于0.4mol,即相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的物质的量小于0.4mol,参加反应的PCl3的物质的量大于1.6mol,故达到平衡时,PCl3的转化率高于1.6mol/2mol=0.8,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球,称取一定量的样品放入其中,按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中。

请回答下列问题:
(1)为测定反应时生成气体的总体积,滴稀H2SO4前必须关闭___(填“K1”、“K2”或“K3”,下同),打开________________。
(2)当上述反应停止时,将K1、K2、K3均关闭,然后先打开K2,再缓缓打开K1,这时可观察到的现象是________________________________。
(3)b中装的固体试剂是______,为何要缓缓打开K1?_______________。
(4)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到y mL气体,则过氧化钠的纯度是_____(用含x、y的式子表示,上述体积均已折算成标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:

(l)在上述有编号的步骤中,需用还原剂的是_______,需用氧化剂的是___________ (填编号)。
在上述循环中,既能与强酸反应又能与强碱反应的两性物质是______(填化学式)。
(3)完成并配平步骤①的化学方程式,并用单线桥法标出电子转移的方向和数目:_______。
□Na2Cr2O7+□KI+□HCl→□CrCl3+□NaCl+□KCl+□I2+□
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)ΔH在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g)ΔH在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是()
A. 0~10 min内,T1时V(CH4)的平均反应速率比T2时的平均反应速率小
B. T2时,CH4的平衡转化率为35%
C. T1时,40min后,断裂4molC-H键同时生成4molO-H
D. 该反应的ΔH >0,T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.2-甲基丁烷也称异丁烷
B.同系物的化学性质基本相似
C.常温下乙酸乙酯在水中的溶解度小于乙醇在水中的溶解度
D.苯与浓硝酸、浓硫酸共热并保持50~60 ℃反应生成硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对危险化学品要在包装标签上印上警示性标志。下列的化学药品名称与警示标志名称对应正确的是( )
A. 酒精——剧毒品 B. 浓硫酸——腐蚀品
C. 汽油——放射性物品 D. 烧碱——易燃固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的的是
A. 在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸
B. 溶于水的固体与难溶于水的固体形成的混合物可用溶解、过滤、蒸发的方法分离
C. 用玻璃棒搅拌漏斗中的液体以加快过滤速度
D. 加入盐酸以除去硫酸钠中的少量碳酸钠杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业制取菱镁矿MgCO3(含杂质Al2O3、FeCO3)制取镁的工艺流程

请回答有关问题:
(1)菱镁矿进入酸浸池前需要粉碎,目的是 __________________________。
(2)氧化池通入Cl2的目的是氧化 _________________________(填化学式),工业上不选用硝酸做氧化剂的原因是_________________和_________________________。
(3)物质甲可以是_____________
A、MgO B、Mg(OH)2 C、NaOH溶液 D、稀氨水
(4)由MgCl2溶液制取无水MgCl2的操作方法 __________________________。
(5)当Fe3+完全沉淀时,求最小pH__________。已知:氢氧化铁ksp=1.0×10-38,离子浓度小于1×10-5 mol/L认为沉淀完全
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com