
C、N、O、Na、Al、S、Cl是常见的元素
(1)C元素位于元素周期表的位置 ;C元素的一种同位素可以测定文物年代,这种同位素的符号为 。
(2)用“>”、“<”或“=”填空
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- Al3+ | H2SO4 HClO4 | O2- S2- | 35Cl 37Cl |
(3)黑火药爆炸时发生反应的化学方程式为:S+2KNO3 +3C==K2S +3CO2↑+N2↑反应生成物中,属于非电解质的是_______(写结构式);其中熔点最高的物质的电子式是_________。
(4)在(3)中化学反应方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_________,能证明其递变规律的事实是( )(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
【知识点】元素周期表、元素周期律、常用化学用语、氧化还原反应 E2
【答案解析】(1)二周期 IVA族 14C (2)> < < =
(3)O=C=O 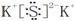 (4)O>N>C, D
(4)O>N>C, D
解析: (1)C元素位于元素周期表第二周期,第IVA族,14C可以测定文物年代;
(2)N3-、Al3为核外电子排布相同的离子,离子核电荷数越大,半径越小,则N3- 大于Al3+;非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;氧气的氧化性大于硫单质,则O2-小于S2-;35Cl与37Cl属于同一种元素,同种元素得电子能力相同。
(3)二氧化碳属于非电解质,分子中C原子与O原子之间形成2对共用电子对,其结构式为O=C=O;沸点最高是K2S,属于离子化合物,由钾离子与硫离子构成,其电子式为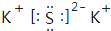 。
。
(4)C、N、O同周期,同周期随原子序数增大元素的非金属性增强,故非金属性O>N>C;
A.氧元素没有含氧酸,不能利用最高价比较氧元素与C、N元素的非金属性,故A错误; B.沸点属于物理性质,不能比较非金属性强弱,故B错误; C.单质与H2反应的难易程度,说明单质的氧化性的强弱,但单质的结构不同,不能说明元素的非金属性的强弱,故C错误; D.元素的化合价,说明共用电子对偏移方向,化合物中表现负价的元素,对键合电子的吸引力更强,非金属性更强,故D正确。
【思路点拨】本题考查了元素周期表、元素周期律、常用化学用语、氧化还原反应等,难度不大,(4)中证明非金属性强弱事实为易错点,学生容易忽略氧元素没有含氧酸及单质的结构的不同。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案科目:高中化学 来源: 题型:
一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,与反应前的体积相比,反应后体积缩小的百分率是( )
A.16.7% B.20.0% C.80.0% D.83.3%
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题。

(1)④、⑤、⑦的原子半径由大到小的顺序为______________(用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为________>__________
(3)④、⑥、⑦的气态氢化物的稳定性由弱到强的顺序是_______________。
(4)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项中,理由、结论及因果关系均正确的是 ( )
A.由于键能EN≡N> ECl-Cl,故单质的沸点:N2>Cl2
B.由于分子中可电离的H+个数H2SO4> CH3COOH,故两者的酸性:H2SO4>CH3COOH
C.由于元素的非金属性N>P,故氢化物的稳定性:NH3>PH3
D.由于金属性Fe>Cu, 故还原性Fe2+>Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
下列微粒的个数比不是1∶1的是 ( )。
A.NaHCO3晶体中阴、阳离子
B.NH3分子中的质子和电子
C.Na2O2固体中阴、阳离子
D.12H原子中的质子和中子
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列几种物质的熔点和沸点数据,判断下列有关说法中,错误的是( )。
| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质B | |
| 熔点/℃ | 810 | 710 | 190 | -68 | 2 300 |
| 沸点/℃ | 1 465 | 1 418 | 182.7 | 57 | 2 500 |
注:AlCl3熔点在2.02×105 Pa条件下测定。
A.SiCl4是分子晶体
B.单质B是原子晶体
C.AlCl3加热能升华
D.MgCl2所含离子键的强度比NaCl大
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,萘可以被硝酸和硫酸的混合酸硝化生成二硝基物,它是1,5二硝基萘 1,8二硝基萘
1,8二硝基萘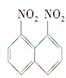 的混合物,后者可溶于质量分数大于98%的硫酸,而前者不能。利用这一性质可将这两种同分异构体分离。将上述硝化产物加入适量98%的硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8二硝基萘,应采用的方法是( )
的混合物,后者可溶于质量分数大于98%的硫酸,而前者不能。利用这一性质可将这两种同分异构体分离。将上述硝化产物加入适量98%的硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8二硝基萘,应采用的方法是( )
A.蒸发浓缩结晶 B.向滤液中加水过滤
C.用碳酸钠溶液处理滤液 D.将滤液缓缓加入水中
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)  2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A 该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B 因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行
C根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol·L-1)3
D达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com