
| A、未加入稀氢氧化钠之前c(CH3COO-)<c(CH3COOH) |
| B、加稀氢氧化钠后溶液中[c(CH3COO-)?c(H+)]/c(CH3COOH)变大 |
| C、加稀氢氧化钠后CH3COOH的电离程度减小,但c( OH-)增大 |
| D、pH=7时,溶液中c( Na+)=c(CH3COO-) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉、纤维素都属于糖类且互为同分异构体 |
| B、戊烷(C5H12)有三种同分异构体 |
| C、乙醇、乙酸、葡萄糖均能发生酯化反应 |
| D、福尔马林、医用酒精均能使蛋白质变性,可用作消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(HCO3-)=1×10-1mol/L的溶液中Na+、AlO2-、CH3COO-、K+ |
| B、由水电离出的c(H+)=1×10-14mol/L的溶液中CO32-、NH4+、SO42-、K+ |
| C、甲基橙呈红色的溶液中Fe2+、Cl-、NO3-、Na+ |
| D、能使pH试纸呈红色的溶液中Mg2+、Cl-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 化学反应及其离子方程式 | 评价 |
| 1 | 醋酸钠溶于水:CH3COO-+H2O═CH3COOH+OH- | 正确 |
| 2 | 在氢氧化钠溶液中滴加少量氯化铝:Al3++3OH-═Al(OH)3↓ | 错误,Al(OH)3能溶于氢氧化钠 |
| 3 | 铁加入到过量的稀硝酸溶液中:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | 正确 |
| 4 | 在硫酸铝钾溶液中滴加氢氧化钡溶液至沉淀的物质的量最多: 3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
错误,Al3+与OH-的化学计量数之比为1:3 |
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,16g O2和O3的混合气体中含有1.5NA个氧原子 |
| B、常温下,1L 1mol?L-1 Na2CO3溶液中所含的CO32-为NA |
| C、58g乙烯和乙烷的混合气体中碳原子数目一定为4NA |
| D、常温常压下,足量的Fe在1mol Cl2中充分燃烧,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
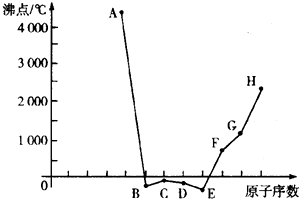
| A、上述元素中,A的最高价氧化物对应的水化物酸性最强 |
| B、简单离子的半径依A、B、C、D的顺序依次减小 |
| C、工业上可通过电解H的熔融氯化物的方法制备H的单质 |
| D、F的简单离子与C、D的简单离子构成的化合物都是盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
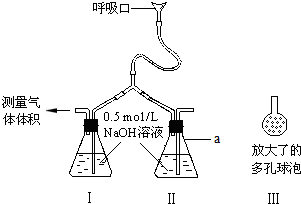 二氧化碳、碳酸钠和碳酸氢钠都是碳的重要化合物,它们在生活生产中都有着广泛的应用.甲、乙、丙三组同学分别对二氧化碳、碳酸钠、碳酸氢钠的相关问题进行了以下探究,请你参与并完成对有关问题的解答.
二氧化碳、碳酸钠和碳酸氢钠都是碳的重要化合物,它们在生活生产中都有着广泛的应用.甲、乙、丙三组同学分别对二氧化碳、碳酸钠、碳酸氢钠的相关问题进行了以下探究,请你参与并完成对有关问题的解答.| 盐酸溶液体积/mL | 40.00 | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.200 | 10.80 | 14.40 | 21.60 |
| CO2质量/g | 3.080 | 4.620 | 3.520 | 0.880 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com