
| A. | CCl4 | B. | BF3 | C. | CO | D. | NH3 |
分析 分子空间结构不对称,正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子;中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,据此判断.
解答 解:A、CCl4分子中价层电子对个数=4+$\frac{1}{2}$×(4-4×1)=4且不含孤电子对,为正四面体结构,为非极性分子,中心原子sp3采用杂化,故A错误;
B、BF3分子中价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=3且不含孤电子对,为平面三角形结构,为非极性分子,中心原子sp2采用杂化,故B错误;
C、CO中C原子形成1个δ键,有1对孤电子对,为sp杂化,故C错误;
D、NH3中N原子形成3个δ键,有1个孤电子对,为sp3杂化,分子构型为三角锥形,空间结构不对称为极性分子,故D正确;
故选D.
点评 本题考查极性分子和非极性分子判断、原子杂化方式判断等知识点,侧重考查基本理论,难点是判断原子杂化方式,知道孤电子对个数的计算方法,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 6种 | C. | 9 种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L硫酸铵溶液中各离子的浓度由大到小的顺序是:c (NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| B. | 在苏打与小苏打的混合溶液中存在:c(Na+)+c(H+)=c(OH -)+2c(CO32-)+c(HCO3-) | |
| C. | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,证明Na2CO3溶液中存在水解平衡 | |
| D. | 常温常压下能自发进行的反应,一定都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
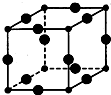 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.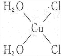 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
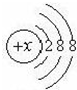 核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:
核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氮不是硝酸的酸酐 | |
| B. | 二氧化氮与水的反应是氧化还原反应 | |
| C. | 二氧化氮不是造成大气污染的气体之一 | |
| D. | 在通常状况下测得的NO2的相对分子质量是不准确的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com