
某化学兴趣小组利用MnO2和浓HCl及如图装置制备Cl2。下列分析中不正确的是 ( )。
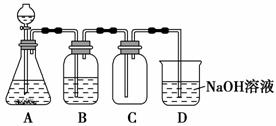
A.A中应用分液漏斗代替长颈漏斗
B.A中缺少加热装置
C.B中盛放的NaOH溶液可以净化Cl2
D.D中的导管口若连接倒置漏斗可防止倒吸
科目:高中化学 来源: 题型:
在反应2SO2+O2
 2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为( )
2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为( )
A. ×100% B.
×100% B. ×100%
×100%
C.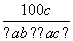 ×100% D.
×100% D. %
%
查看答案和解析>>
科目:高中化学 来源: 题型:
丙烯酸(CH2=CH—COOH)的性质可能有:
① 加成反应;②取代反应;③酯化反应;④ 中和反应;⑤ 氧化反应;
A.只有①③ B.只有①③④ C.只有①③④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内分别装有滴有不同溶液的白色棉球,反应一段时间后,对图中指定部分颜色描述正确的是 ( )。
| ① | ② | ③ | ④ | |
| A | 黄绿色 | 橙色 | 蓝色 | 白色 |
| B | 无色 | 橙色 | 紫色 | 白色 |
| C | 黄绿色 | 橙色 | 蓝色 | 无色 |
| D | 黄绿色 | 无色 | 紫色 | 白色 |
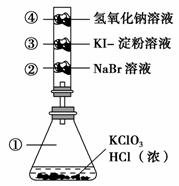
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与含氯化合物有关的说法正确的是 ( )。
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题。
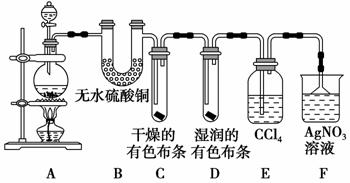
(1)装置B、E的作用分别为_________________________________,
________________________________。
(2)装置C、D的作用分别为________________________________________,
________________________________。
(3)装置F中AgNO3溶液的作用是________,倒置漏斗的作用是________。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间加一个装置。你认为该装置加在________与________之间(填装置各部分字母),装置中应放入________,作用是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于SiO2和CO2的叙述中不正确的是 ( )。
A.都是共价化合物
B.都是酸性氧化物,都能与强碱溶液反应
C.都能溶于水且与水反应生成相应的酸
D.SiO2可用于制光导纤维,干冰可用于人工降雨
查看答案和解析>>
科目:高中化学 来源: 题型:
将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是 ( )。
A.原混合物中铜和铁各0.15 mol
B.稀硝酸的物质的量浓度为1 mol·L-1
C.第一次剩余的9.6 g金属为铜和铁
D.再加入上述200 mL稀硝酸,又得到标准状况下2.24 L NO
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是现今人类生产生活中使用广泛性仅次于铁的重要金属。工业上常以“钒土矿”为原料来冶炼金属铝。已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质)。为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:
①取矿样10.0 g加入过量稀盐酸溶解(假定其他未知成分的杂质都不溶于盐酸,也不和盐酸反应),过滤弃去不溶残渣。
②将滤液稀释并在250 mL容量瓶中定容后,取25.0 mL逐滴滴加2.0 mol·L-1的NaOH溶液,得到如图所示的变化关系。请根据有关数据回答下列问题:

(1)写出滴加NaOH溶液24~30 mL时发生反应的离子方程式:______________________________。
(2)最后所得不溶于NaOH溶液的沉淀的化学式为________,其物质的量为______________。
(3)该“钒土矿”样中Al2O3的质量分数为________。
(4)工业上制取金属铝的化学反应原理可表示为
2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
用10.0 t “钒土矿”样提纯所得的Al2O3(提纯过程的损耗忽略不计)进行电解,理论上最多可制得金属铝________ t,假定Al2O3在熔融状态完全电离为Al3+和O2-,则电解过程的阳极反应式为_____________________ ___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com