
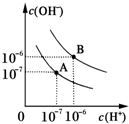
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:

科目:高中化学 来源: 题型:
 如图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中C均为金属单质,H的焰色反应呈黄色,在通常状况下E跟NaOH或盐酸均可以发生反应.(反应过程中生成的水及其他产物已略去)请回答以下问题.
如图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中C均为金属单质,H的焰色反应呈黄色,在通常状况下E跟NaOH或盐酸均可以发生反应.(反应过程中生成的水及其他产物已略去)请回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | ||
| B、所有的化学反应都需要一定的活化能来推动 | ||
C、CH3COOH 溶液加水稀释后,溶液中
| ||
| D、Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.0kJ/mol.t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如图所示.
T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.0kJ/mol.t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用于海上照明供电 |
| B、负极反应为AgCl+e-═Ag+Cl- |
| C、Mg为电池的正极 |
| D、AgCl为阳极,发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性:I2>H2SO4>Cl2>Fe3+ |
| B、还原性:Cl->Fe2+>SO2>I- |
| C、氧化性:Cl2>Fe3+>I2>H2SO4 |
| D、还原性:SO2>Fe2+>I->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、27g H2O |
| B、标准状况下,33.6L CO2 |
| C、6.02×1023个O2分子 |
| D、含1mol 氧原子的SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com