

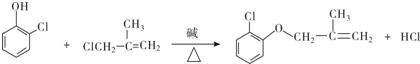
 (有机物用结构简式表示,下同).
(有机物用结构简式表示,下同).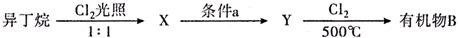
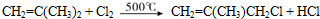 ;
;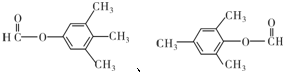
分析 (1)根据A的结构简式可知A的核磁共振氢谱中峰的数目,比较E和F的结构简式可知,E中的氯原子被羟基取代即得F,根据C和D的结构简式可知,C和D中都含有氯原子和碳碳双键;
(2)根据D的结构简式可知,D中有苯环和酚羟基、氯原子、碳碳双键,据此判断;
(3)根据元素守恒和C的结构可知,B为CH2=C(CH3)CH2Cl,进而可写出化学反应方程式;
(4)CH3CH(CH3)2与氯气按1:1发生取代反应生成X为CH2ClCH(CH3)2,X发生消去反应得Y为CH2=C(CH3)2,Y与氯气发生取代反应生成CH2=C(CH3)CH2Cl,据此答题;
(5)呋喃酚的同分异构体符合下列条件①苯环上的一氯代物只有一种,②能发生银镜反应的芳香酯,说明有醛基或甲酸某酯及苯环的结构,据此写同分异构体;
解答 解:(1)根据A的结构简式可知A的核磁共振氢谱中峰的数目为5,比较E和F的结构简式可知,E中的氯原子被羟基取代即得F,即反应④为取代反应(或水解反应),根据C和D的结构简式可知,C和D中都含有氯原子和碳碳双键,
故答案为:5;取代反应(或水解反应);氯原子和碳碳双键;
(2)根据D的结构简式可知,D中有苯环和酚羟基、氯原子、碳碳双键,可以和溴水发生取代反应,被酸性K2Cr2O7溶液氧化,能与纯碱溶液反应生成碳酸氢钠,
故选:A B D;
(3)根据元素守恒和C的结构可知,B为CH2=C(CH3)CH2Cl,所以反应①的化学反应方程式为 ,
,
故答案为: ;
;
(4)CH3CH(CH3)2与氯气按1:1发生取代反应生成X为CH2ClCH(CH3)2,X发生消去反应得Y为CH2=C(CH3)2,反应条件为氢氧化钠的乙醇溶液、加热,Y与氯气发生取代反应生成CH2=C(CH3)CH2Cl,反应的方程式为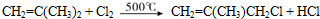 ,
,
故答案为:氢氧化钠的乙醇溶液、加热;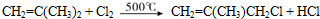 ;
;
(5)呋喃酚的同分异构体符合下列条件①苯环上的一氯代物只有一种,②能发生银镜反应的芳香酯,说明有醛基或甲酸某酯及苯环的结构,则符合条件的同分异构体为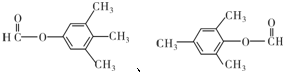 ,
,
故答案为: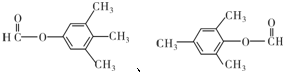 .
.
点评 本题考查有机物的合成、有机物结构与性质、同分异构体书写等,注意根据合成流程中的反应、官能团变化等为解答的关键,侧重分析与应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 100 mL 1 mol/L的盐酸中含HCl分子数为0.1NA | |
| B. | 7.8 g Na2O2和Na2S的混合物中阴离子数目为0.2NA | |
| C. | 标准状况下,2.24 L SO3中含有氧原子数目为0.3NA | |
| D. | 2 g D216O中含中子、质子、电子数目均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如右,该燃料电池工作时,外电路中电子的流动方向是从电极1到电极2;电池的总反应为4NH3+3O2=2N2+6H2O.
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如右,该燃料电池工作时,外电路中电子的流动方向是从电极1到电极2;电池的总反应为4NH3+3O2=2N2+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2015年12月11日瑞典斯德哥尔摩诺贝尔奖颁奖典礼举行,授予中国女药学家屠呦呦、美国科学家威廉•坎贝尔和日本大村智诺贝尔医学奖,以表彰他们在寄生虫疾病治疗方面取得的成就.屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图,下列说法错误的是( )
2015年12月11日瑞典斯德哥尔摩诺贝尔奖颁奖典礼举行,授予中国女药学家屠呦呦、美国科学家威廉•坎贝尔和日本大村智诺贝尔医学奖,以表彰他们在寄生虫疾病治疗方面取得的成就.屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图,下列说法错误的是( )| A. | 青蒿素的分子式为C15H22O5 | B. | 青蒿素是芳香族化合物 | ||
| C. | 青蒿素可以发生水解反应 | D. | 青蒿素含有过氧结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在实验过程中水的电离程度的变化趋势是先减小后增大 | |
| B. | 当滴加盐酸至溶液pH<7时,此时溶液中溶质一定是HCl和NH4Cl | |
| C. | 当滴加盐酸至溶液pH=7时,此时溶液中,c(NH4+)>c(Cl-) | |
| D. | 当滴加盐酸至恰好完全中和时,c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.10 mol•L-1的醋酸钠溶液20mL与0.10 mol•L-1盐酸10mL混合后溶液显酸性:c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH) | |
| B. | pH=7的醋酸钠和醋酸混合液中:c(Na+)=c(CH3COO-)=c (H+)=c(OH-) | |
| C. | 若0.10 mol•L-1的醋酸的pH=a,0.010 mol•L-1的醋酸的pH=b,则a+1>b | |
| D. | 已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com