
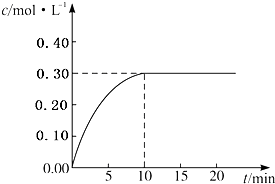
 目前工业上通常用生产水煤气的方法获得,反应的化学方程为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.若在某一容积为4L的密闭容器内,加入2.0mol的CO和3.0mol的H2O(g),在催化剂存在的条件下于850℃高温加热,发生上述反应,反应中CO2的浓度随时间变化情况如图所示:
目前工业上通常用生产水煤气的方法获得,反应的化学方程为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.若在某一容积为4L的密闭容器内,加入2.0mol的CO和3.0mol的H2O(g),在催化剂存在的条件下于850℃高温加热,发生上述反应,反应中CO2的浓度随时间变化情况如图所示:| 2 |
| 4 |
| 3 |
| 4 |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| 0.3×0.3 |
| 0.2×0.45 |
| 0.3 |
| 0.5 |
| 1×5 |
| 1×3 |
| 1×x |
| 1×3 |


科目:高中化学 来源: 题型:
| A、化学平衡常数与温度无关 |
| B、两种物质反应,不管怎样书写化学方程式,平衡常数不变 |
| C、化学平衡常数等于某时刻生成物浓度幂之积与反应物浓度幂之积的比值 |
| D、温度一定,对于给定的化学反应,正逆反应的平衡常数互为倒数 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 铝和氢氧化钾都是重要的工业产品.请回答:
铝和氢氧化钾都是重要的工业产品.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-、NH4+、H+、Ca2+ |
| B、SO42-、H+、Cl-、NO3- |
| C、K+、Ag+、Na+、CO32- |
| D、Mg2+、OH-、SO32-、Cl-- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、⑥⑤②①④③ |
| B、⑥⑤①②③④ |
| C、④③②①⑤⑥ |
| D、④③①②⑥⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com