


分析 (1)二氧化硫和氮氧化物是形成酸雨的主要气体;
(2)①①N2(g)+O2(g)?2NO(g)△H=+180.50kJ•mol-1
②4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.48kJ•mol-1
根据盖斯定律,①×5+②得到:4NH3(g)+6NO(g)=5N2(g)+6H2O(g);
②该反应是放热及体积增大的可逆反应,升高温度或增大压强,平衡均逆向移动;
(3)①NO得电子生成铵根;
②SO2失电子形成硫酸;
(4)①燃油气燃烧更充分;
②反应 N2(g)+O2(g)?2NO(g) 是吸热反应.
解答 解:(1)二氧化硫和氮氧化物是形成酸雨的主要气体,故答案为:SO2 和 NOX;
(2)①已知①N2(g)+O2(g)=2NO(g);△H=180.50kJ•mol-l
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905.48kJ•mol-l
氨气被一氧化氮氧化生成氮气和气态水的热化学方程式依据盖斯定律,结合热化学方程式合并计算:①×5+②得到:
4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1807.98kJ/mol,故答案为:a;
②,该反应是放热及体积增大的可逆反应,升高温度或增大压强,平衡均逆向移动,使NH3的体积分数增大,故答案为:温度或压强;因为该反应是放热及体积增大的可逆反应,升高温度或增大压强,平衡均逆向移动,使NH3的体积分数增大;
(3)①NO得电子生成铵根,离子方程式:NO+5e-+6H+=NH4++H2O,故答案为:NO+5e-+6H+=NH4++H2O;
②SO2失电子形成硫酸,反应方程式:5SO2+2NO+8H2O$\frac{\underline{\;通电\;}}{\;}$(NH4)2SO4+4H2SO4,故答案为:H2SO4;根据反应:5SO2+2NO+8H2O$\frac{\underline{\;通电\;}}{\;}$(NH4)2SO4+4H2SO4,产物中除有(NH4)2SO4外还有H2SO4;
(4)①空/燃比增大,燃油气燃烧更充分,故答案为:空/燃比增大,燃油气燃烧更充分,故CO、CxHy含量减少;
②反应 N2(g)+O2(g)?2NO(g) 是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,故答案为:因为反应 N2(g)+O2(g)?2NO(g) 是吸热反应,当空/燃比大于15后,由于燃油气
含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,使该反应不易进行,故NOx减少.
点评 本题考查了盖斯定律在反应热计算中的应用、电解原理以及燃料的充分燃烧,题目难度中等,注意掌握盖斯定律的概念,试题培养了学生灵活应用所学知识.


科目:高中化学 来源: 题型:解答题
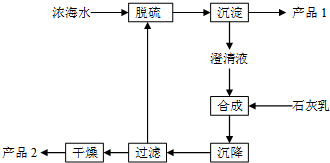 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品. _.
_.| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子的能量越低,运动区域离原子核越远 | |
| B. | 核外电子的分层排布即是核外电子的分层运动 | |
| C. | 稀有气体元素原子的最外层都排有8个电子 | |
| D. | 当M层是最外层时,最多可排18个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热大于110.5 kJ•mol-1 | |
| B. | ①的反应热为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液反应的成1 mol水,放出57.3 kJ热量 | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 改用98%的浓硫酸 | ||
| C. | 改用锌粒 | D. | 滴加少量CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 操作 | 现象 |
| Ⅰ | 把氯水点在蓝色石蕊试纸上 | 试纸先变红后褪色 |
| Ⅱ | 向氯水中滴加足量AgNO3溶液,不断振荡 | ⅰ.有白色沉淀生成 ⅱ.稍后,溶液变为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com