
【题目】下列实验方案的设计能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 验证 | 向 |
B | 比较HF与 | 常温下,用pH试纸分别测定浓度均为 |
C | 验证 | 向 |
D | 比较Fe与Cu的金属活动性 | 常温下,将Fe、Cu与浓硝酸组成原电池 |
A.AB.BC.CD.D
【答案】C
【解析】
A.由于还原性Fe2+>Br-,则向FeBr2溶液中通入少量Cl2,可能只有Fe2+被氧化,不能得出Cl2的氧化性强于Br2,A选项错误;
B.NaClO溶液具有漂白性,不能用pH试纸测定其pH从而判断酸性强弱,B选项错误;
C.向1mL0.1mol·L-1FeCl3溶液中滴加5mL0.1mol·L-1KI溶液,KI过量,若充分反应后加入KSCN溶液变成红色,证明有三价铁离子存在,可说明反应是可逆反应,C选项正确;
D.常温下,将Fe、Cu与浓硝酸组成原电池,Fe和浓硝酸发生钝化现象,Cu与浓硝酸能自发的发生氧化还原反应,所以Cu作负极,Fe做正极,不能判断Fe的金属活动性大于Cu,D选项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】下面四种变化中,有一种变化与其他三种变化类型不同的是( )
A.CH3CH2OH + CH3COOH ![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
B.CH3CH2Br+NaOH ![]() CH2=CH2↑+NaBr+H2O
CH2=CH2↑+NaBr+H2O
C.2CH3CH2OH![]() CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
D.CH3CH2OH + HBr→CH3CH2Br + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(MnS)=2.5×10-13,Ksp(FeS)=6.3×10-18。FeS和MnS在水中的沉淀溶解平衡曲线如图所示(X2+表示Fe2+或Mn2+),下列说法错误的是( )
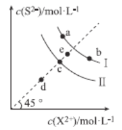
A.曲线I表示MnS的沉淀溶解平衡曲线
B.升高温度,曲线Ⅱ上的c点可沿虚线平移至d点
C.常温下,反应MnS(s)+Fe2+(aq)![]() FeS(s)+Mn2+(aq)的平衡常数K≈4×104
FeS(s)+Mn2+(aq)的平衡常数K≈4×104
D.向b点溶液中加入少量Na2S固体,溶液组成由b点沿工线向a点方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“臭碱![]() ”广泛应用于冶金染料、皮革、电镀等工业,可利用反应
”广泛应用于冶金染料、皮革、电镀等工业,可利用反应![]() 制备。已知
制备。已知![]() ,
,![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.反应中生成1 mol“臭碱”时转移电子数为![]()
B.该反应的氧化产物与还原产物的物质的量比为![]()
C.![]() 溶液中含有的阴离子数目大于
溶液中含有的阴离子数目大于![]()
D.将![]() 溶液露置于空气中不会有
溶液露置于空气中不会有![]() 气体放出
气体放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室利用氢氧化钠、盐酸分离铁粉和铝粉混合物,物质转化关系如图所示:

下列说法不正确的是( )
A. x为NaOH溶液,y为盐酸
B. a→b发生的反应为:AlO2-+H++H2O═Al(OH)3↓
C. b→c→Al的反应条件分别为:加热、电解
D. a、b、c既能与酸又能与碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列四种溶液中,由水电离生成的氢离子浓度之比是( )
①1 mol·L-1的盐酸 ②0.1 mol·L-1的盐酸
③0.01 mol·L-1的NaOH溶液 ④1 mol·L-1的NaOH溶液
A. 1∶10∶100∶1 B. 1∶10-1∶10-12∶10-14
C. 14∶13∶12∶14 D. 14∶13∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(![]() )是新型的绿色环保水处理剂。一种制备
)是新型的绿色环保水处理剂。一种制备![]() 的流程如下:
的流程如下:
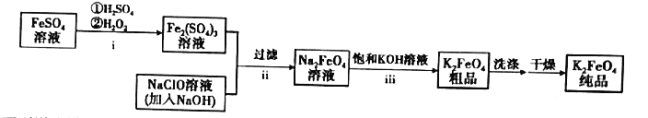
下列说法错误的是( )
A.步骤i中反应的离子方程式为![]()
B.步骤ⅱ说明碱性条件下,氧化性:![]()
C.步骤ⅲ的反应为复分解反应,说明溶解度:![]()
D.![]() 作为性能优良的水处理剂,主要是利用了其强氧化性和还原后产生的具有絮凝作用的Fe(Ⅲ)
作为性能优良的水处理剂,主要是利用了其强氧化性和还原后产生的具有絮凝作用的Fe(Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一瓶无色澄清溶液,其中可能含H+、Na+、Mg2+、Ba2+、Cl、SO42、CO32离子。现进行以下实验:
A、用pH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有_________________________;
肯定不存在的离子有___________________________。
②写出C中发生反应的离子方程式________________________________。
(2)①还原铁粉与高温水蒸气反应的化学方程式:_____________________________;
②除去Mg粉中的Al粉的试剂是__________________,反应的离子方程式为:___________________________________;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
____Fe(OH)3 +____ClO-+____OH- =__FeO42-+___Cl-+_____ _______
(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是___________;
当有2mol H3PO4生成,转移的电子的物质的量为__________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com