
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| C. | 金属铝溶于氢氧化钠溶液 Al+2OH-=AlO2-+H2↑ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |
分析 A.电荷不守恒;
B.反应生成碳酸钙和氢氧化钙和水;
C.电荷不守恒;
D.不符合反应客观事实.
解答 解:A.FeCl2溶液中通入Cl2,离子方程式:2Fe2++Cl2=2Fe3++2Cl-,故A错误;
B.澄清石灰水与少量小苏打溶液混合,离子方程式:Ca2++OH-+HCO3-=CaCO3↓+H2O,故B正确;
C.金属铝溶于氢氧化钠溶液,离子方程式:2Al+2H2O+2OH-=2AlO2-+3H2↑,故C错误;
D.氨水中的一水合氨是弱电解质要写成分子式的形式,所以向AlCl3溶液中加入过量的氨水,其离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选:B.
点评 本题考查离子反应方程式的正误判断,明确发生的化学反应及离子反应的书写方法即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O +HCl→
+HCl→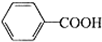 ↓+KCl
↓+KCl| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 水 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -96 | 不溶 | 易容 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 (100℃升华) | 25℃0.35g 80℃2.7g | 易容 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其中Y原子的杂化方式是sp,ZW3-的空间构型为平面三角形.
,其中Y原子的杂化方式是sp,ZW3-的空间构型为平面三角形.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
其它 | 阳离子核外无电子 | 可做半导体材料 | 焰色反应呈黄色 |
 ,R在自然界中有质量数为35和37的两种核素,它们之间的关系互为同位素.
,R在自然界中有质量数为35和37的两种核素,它们之间的关系互为同位素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁是最常见的金属材料.铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物.
铁是最常见的金属材料.铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com