
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1) 铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中计入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml滴定中MnO4-,被还原成Mn2+ 。
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98ml
请回答下列问题:
① 配制三草酸合铁酸钾溶液的操作步骤依次是:称量、_______、转移、洗涤并转移、________摇匀。
② 加入锌粉的目的是________。
③ 写出步骤三中发生反应的离子方程式________。
④ 实验测得该晶体中铁的质量分数为__________。在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量__________。(选填“偏低”“偏高”“不变”)
(2) 结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_________。
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
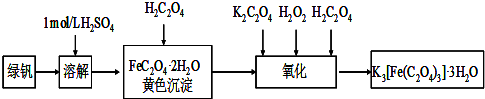
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
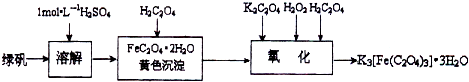
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
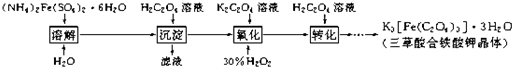
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
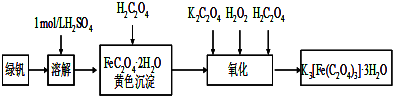
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com