
利用原料气在合成塔中合成NH3,为提高N2的转化率应采取的措施是( )
A.高温 B.高压 C.使用催化剂 D.增大N2的浓度
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列有关铁及其化合物的说法中正确的是( )
A.磁铁矿的主要成分是Fe2O3
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加过量铁粉,然后过滤
D.Fe3+与KSCN反应产生血红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈 紫色。
紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是_____________,此液体具有的性质是________(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为____________。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸该酸的某盐常用于实验室制取氧气的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转 移时,该反应的化学方程式是_______________。
移时,该反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.精炼铜时粗铜作阴极,纯铜作阳极
B.工业上利用电解饱和AlCl3溶液的方法生产金属铝
C.氯碱工业和金属钠的冶炼都用到了NaCl,阳极反应都是2Cl--2e-====Cl2↑
D.钢铁的腐蚀通常为电化学腐蚀,该腐蚀过程中负极反应为Fe-3e-====Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
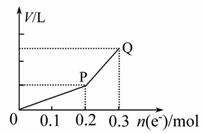 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体的总体积的关系如下图所示(气体体积均在相同状况下测定),欲使电解质溶液恢复到起始状态,应向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体的总体积的关系如下图所示(气体体积均在相同状况下测定),欲使电解质溶液恢复到起始状态,应向溶液中加入( )
A.0.1 mol CuO
B.0.1 mol CuCO3
C.0.1 mol Cu(OH)2
D.0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
在合成氨时,要使氨的产率增大,又要使化学反应速率增大,可以采取的措施有( )
①增大体积使压强减小 ②减小体积使压强增大 ③升高温度 ④降低温度 ⑤恒温恒容,再充入等量的N2和H2
⑥恒温恒压,再充入等量的N2和H2 ⑦及时分离产生的NH3 ⑧使用正催化剂
A.②④⑤⑦ B.②③④⑤⑦⑧ C.②⑤ D.②③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。达到平衡时平衡混合物中NH3的含量(体积分数)[入料V(N2)∶V(H2)=1∶3]
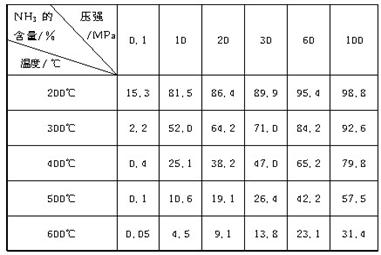
(1)比较200℃和300℃时的数据,可判断升高温度,平衡向____________方向移动,正反应方向为________(填“吸热”或“放热”)反应。
(2)根据平衡移动原理,合成氨适宜的条件是________。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(3)计算500℃,30 MPa时N2的转化率________。
(4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施:________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:某温度时,Ksp(AgCl)=1.8×10-10 mol2·L-2,Ksp(Ag2CrO4)=1.1×10-12 mol3·L-3。
试求:
(1)此温度下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度,并比较两者的大小。
(2)此温度下,在0.010 mol·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度,并比较两者的大小。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在0.1 mol·L-1的NaHSO3溶液中有关微粒浓度由大到小的顺序为[Na+]>[HSO ]>[SO
]>[SO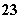 ]>[H2SO3]。
]>[H2SO3]。
(1)该溶液中[H+]________[OH-](填“>”、“<”或“=”),简述理由:
________________________________________________________________________
________________________________________________________________________。
(2)现向NH4HSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象是________________________________________________________________________
________________________________________________________________________;
写出该反应的离子方程式
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com