
 南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验:
南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验:分析 (1)硬水中含有较多的Ca2+、Mg2+离子,阴离子含有HCO3-,加热时碳酸氢盐分解可生成难溶的CaCO3或MgCO3沉淀;
(2)依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
(3)聚丙烯酸钠的单体为丙烯钠;
(4)铝离子水解生成氢氧化铝和氢离子,氢氧化铝具有吸附性能够吸附杂质颗粒,可以用来净水;
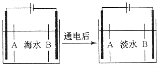
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;
②根据阳极是氯离子放电,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大.
解答 解:(1)通常按水中Ca2+、Mg2+的多少,把天然水分为硬水和软水.含有较多Ca2+、Mg2+的水叫做硬水;如果水的硬度是由Ca(HCO3)2或Mg(HCO3)2所引起的,这种硬度叫做暂时硬度.具有暂时硬度的水可以用加热的方法进行软化,方程式为Ca2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+CO2↑+H2O或Mg2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3↓+CO2↑+H2O,
故答案为:Ca2+、Mg2+;Ca2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+CO2↑+H2O或Mg2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3↓+CO2↑+H2O,MgCO3+H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑;
(2)某天然水中c(Ca2+)=1.2×10-3mol•L-1,c(Mg2+)=6×10-4mol•L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,水的硬度=$\frac{67.2mg}{10mg}$+$\frac{24mg}{7.1mg}$=10°,属于硬水;
故答案为:是;
(3)聚丙烯酸钠的单体为丙烯钠,结构简式:CH2=CHCOONa,
故答案为:CH2=CHCOONa;
(4)铝离子水解生成氢氧化铝和氢离子,离子方程式:Al3++3H2O?Al(OH)3(胶体)+3H+,
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜B和阴极相连,阴极是阳离子放电,所以隔膜B是阳离子交换膜,
故答案为:B;
②根据阳极是氯离子放电:2Cl--2e-═Cl2↑,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大,和钙离子,镁离子形成沉淀,
故答案为:2Cl--2e-═Cl2↑;电极上产生气泡,溶液中出现白色沉淀.
点评 本题考查了化学和生活,涉及硬水及其软化,明矾净水等,明确相关概念及电解原理是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
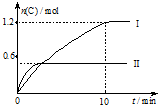 在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1
在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1| 实验序号 | 温度 | 起始物质的量 | |
| A | B | ||
| Ⅰ | 600℃ | 1mol | 3mol |
| Ⅱ | 800℃ | 1.5mol | 0.5mol |
| A. | 实验 I中,10 min内平均反应速率v(B)=0.06 mol•L-1•min-1 | |
| B. | 上述方程式中,a<0 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 molB,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热或点燃H2、CO、CH4等可燃性气体参与反应时,都要先检验纯度再加热或点燃. | |
| B. | 将SO2通入酸性高锰酸钾溶液中,紫红色褪去,说明SO2具有漂白性 | |
| C. | KNO3与NaCl的混合物,通过结晶法一次分离就可得到两种纯净物 | |
| D. | 检验硫酸亚铁铵溶液中Fe2+的方法是:先滴加新制氯水,后滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | A | B | C | D | E |
| 相关 信息 | A元素原子核外有3个电子层,最外层有3个电子. | 与元素C可形成离子个数比 为2:1和1:1的化合物 | C元素的原子K、L层电子数之和比L、M层电子数之和多1个电子 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属, 人体缺少该元素易患贫血症 |
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
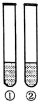 下列“试剂”和“试管中的物质”不能完成“实验目的”的是( )
下列“试剂”和“试管中的物质”不能完成“实验目的”的是( ) | 实验目的 | 试剂 | 试管中的物质 | |
| A | 浓度对硫酸的性质有影响 | Fe | ①稀硫酸;②浓硫酸 |
| B | 羟基对苯环活性有影响 | 饱和溴水 | ①苯;②苯酚 |
| C | 甲基对苯环活性有影响 | 酸性KMnO4溶液 | ①苯;②甲苯 |
| D | 碳酸钠溶液碱性比碳酸氢钠溶液强 | 酚酞溶液 | ①碳酸钠溶液 ②碳酸氢钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该过程中仅有物理变化,没有化学变化 | |
| B. | 该过程描述的是一个可逆反应的两个方向 | |
| C. | 该过程设计的反应中包括HgS$\frac{\underline{\;\;△\;\;}}{\;}$Hg+S | |
| D. | 水银有毒,所以生活中绝对不能使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
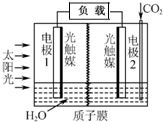 利用人工模拟光合作用合成甲酸的原理为:2CO2+2H2O$→_{光触媒}^{太阳能}$ 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
利用人工模拟光合作用合成甲酸的原理为:2CO2+2H2O$→_{光触媒}^{太阳能}$ 2HCOOH+O2,装置如图所示,下列说法不正确的是( )| A. | 电子由电极1经过负载流向电极2 | |
| B. | 若将质子膜换成阴离子交换膜,该电池依然能够正常工作 | |
| C. | 电极2的反应式:CO2+2H++2e-=HCOOH | |
| D. | 该装置能将太阳能转化为化学能和电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品 | |
| B. | NH3 能与Cl2 生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏 | |
| C. | NaHCO3 能与碱反应,食品工业用作焙制糕点的膨松剂 | |
| D. | K2FeO4 能与水作用生成Fe(OH)3 胶体和O2,可用于净化自来水并杀菌消毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com