
| A. | Na+、Fe2+、NO3-、Cl- | B. | Na+、K+、NO3-、Cl- | ||
| C. | Na+、K+、Al(OH)4-、Cl- | D. | NH4+、K+、SO42-、HCO3- |
分析 溶液中由水电离产生的c(OH-)=1.0×10-13 mol/L,该溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,
A.亚铁离子与氢氧根离子反应,酸性条件下硝酸根离子氧化亚铁离子;
B.四种离子之间不反应,都不与氢离子和氢氧根离子反应;
C.Al(OH)4-与酸性溶液中的氢离子反应;
D.铵根离子与氢氧根离子反应,碳酸氢根离子与氢氧根离子和氢离子反应.
解答 解:溶液中由水电离产生的c(OH-)=1.0×10-13 mol/L,该溶液中存在大量氢离子或氢氧根离子,
A.Fe2+、NO3-之间在酸性条件下发生氧化还原反应,Fe2+与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.Na+、K+、NO3-、Cl-之间不反应,都不与氢离子和氢氧根离子反应,在溶液中能够能够大量共存,故B正确;
C.Al(OH)4-与氢离子反应,在酸性溶液中不能大量共存,故C错误;
D.HCO3-与氢离子和氢氧根离子反应,NH4+与氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,是“可能”共存,还是“一定”共存等.


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:多选题
| A. | Cl2是氧化剂,KOH是还原剂 | |
| B. | KClO3是氧化产物,KCl是还原产物 | |
| C. | 该反应中氯气既体现了氧化性又体现了还原性 | |
| D. | 若生成1mol KClO3,则反应中转移10mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质微粒直径的大小关系:溶液>胶体>浊液 | |
| B. | 胶体粒子很小,但不能通过半透膜 | |
| C. | Fe(OH)3胶体带正电荷 | |
| D. | 向沸水中加入Fe(OH)3可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

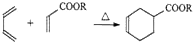

 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$
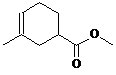 、
、 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 量取8.0mL 5.0mol•L-1H2SO4溶液,加蒸馏水稀释至100mL,取两份稀释后的H2SO4溶液各25mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积).请计算:
量取8.0mL 5.0mol•L-1H2SO4溶液,加蒸馏水稀释至100mL,取两份稀释后的H2SO4溶液各25mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积).请计算:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4中含有的分子数目为NA | |
| B. | 7.8gNa2S和Na2O2的混合物中,含有的阴离子数目为0.1NA | |
| C. | 足量的铜与含有0.2molH2SO4的浓溶液共热可生成SO2为0.1NA | |
| D. | 标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 0.5mol/L MgCl2溶液 | B. | 200mL 0.25mol/L CaCl2溶液 | ||
| C. | 50mL 1mol/L NaCl溶液 | D. | 250mL 0.2mol/L HCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com