
 ŅŃÖŖ£ŗ¢ŁCH4£Øg£©+H2O£Øg£©ØTCO£Øg£©+3H2£Øg£©”÷H=+206.2kJ/mol
ŅŃÖŖ£ŗ¢ŁCH4£Øg£©+H2O£Øg£©ØTCO£Øg£©+3H2£Øg£©”÷H=+206.2kJ/mol| ĪĀ¶Č£Ø”ę£© | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| Ę½ŗāĘųĢå×ÜÅØ¶Č£Ø”Į10-3mol/L£© | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
·ÖĪö £Ø1£©ŅŃÖŖ£ŗ¢ŁCH4£Øg£©+H2O£Øg£©ØTCO£Øg£©+3H2£Øg£©”÷H=+206.2kJ/mol
¢ŚCH4£Øg£©+CO2£Øg£©ØT2CO£Øg£©+2H2£Øg£©”÷H=-247.4kJ/mol
øł¾ŻøĒĖ¹¶ØĀÉ£¬¢Ł”Į2-¢ŚæÉµĆ£ŗCH4£Øg£©+2H2O£Øg£©=CO2£Øg£©+4H2£Øg£©£»
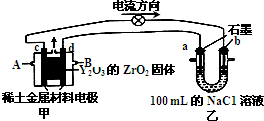
£Ø2£©¢ŁÓɵēĄė·½Ļņ£¬æÉÖŖcĪŖÕż¼«”¢dĪŖøŗ¼«£¬øŗ¼«ÉĻŹĒ¼×Ķ鏧Ȅµē×Ó£¬ÓėY2O3µÄZrO2¹ĢĢå“«µ¼µÄO2-½įŗĻĪŖ¶žŃõ»ÆĢ¼ÓėĖ®£»
¢ŚŅŅĪŖµē½ā³Ų£¬×Ü·“Ó¦Ź½ĪŖ£ŗ2NaCl+2H2O$\frac{\underline{\;µē½ā\;}}{\;}$2NaOH+H2”ü+Cl2”ü£¬aµē¼«ĪŖŅõ¼«£¬Éś³ÉĘųĢåĪŖĒāĘų£¬¼ĘĖćĒāĘųĪļÖŹµÄĮ棬øł¾Ż·½³ĢŹ½¼ĘĖćNaOHĪļÖŹµÄĮ棬ŌŁ¼ĘĖćNaOHÅØ¶Č£¬øł¾ŻKw¼ĘĖćĒāĄė×ÓÅØ¶Č£¬øł¾ŻpH=-lgc£ØH+£©¼ĘĖćČÜŅŗpH£»
£Ø3£©¢ŁÓɱķÖŠŹż¾ŻæÉÖŖ£¬ĖęĪĀ¶ČÉżøߣ¬Ę½ŗāĘųĢå×ÜÅضČŌö“ó£¬ĖµĆ÷ÉżøßĪĀ¶ČĘ½ŗāÕżĻņŅĘ¶Æ£¬Õż·“Ó¦ĪŖĪüČČ·“Ó¦£»
¢ŚæÉÄę·“Ó¦µ½“ļĘ½ŗāŹ±£¬Ķ¬ÖÖĪļÖŹµÄÕżÄęĖŁĀŹĻąµČĒŅ±£³Ö²»±ä£¬ø÷×é·ÖµÄÅØ¶Č”¢ŗ¬Įæ±£³Ö²»±ä£¬ÓÉ“ĖŃÜÉśµÄĘäĖüŅ»Š©Įæ²»±ä£¬ÅŠ¶ĻĘ½ŗāµÄĪļĄķĮæÓ¦Ėę·“Ó¦½ųŠŠ·¢Éś±ä»Æ£¬øĆĪļĄķĮæÓɱä»Æµ½²»ŌŁ±ä»ÆĖµĆ÷µ½“ļĘ½ŗā£»
¢Ū»ģŗĻĘųĢåÖŠNH3£Øg£©”¢CO2£Øg£©ĪļÖŹµÄĮæÖŠĪŖ2£ŗ1£¬¼ĘĖćø÷×ŌÅØ¶Č£¬“śČėK=c2£ØNH3£©”Įc£ØCO2£©¼ĘĖć£»
£Ø4£©øł¾ŻKsp[Mg£ØOH£©2]=c2£ØOH-£©”Įc£ØMg2+£©=1.8”Į10-11¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©ŅŃÖŖ£ŗ¢ŁCH4£Øg£©+H2O£Øg£©ØTCO£Øg£©+3H2£Øg£©”÷H=+206.2kJ/mol
¢ŚCH4£Øg£©+CO2£Øg£©ØT2CO£Øg£©+2H2£Øg£©”÷H=-247.4kJ/mol
øł¾ŻøĒĖ¹¶ØĀÉ£¬¢Ł”Į2-¢ŚæÉµĆ£ŗCH4£Øg£©+2H2O£Øg£©=CO2£Øg£©+4H2£Øg£©”÷H=+659.8 kJ/mol£¬
¹Ź“š°øĪŖ£ŗCH4£Øg£©+2H2O£Øg£©=CO2£Øg£©+4H2£Øg£©”÷H=+659.8 kJ/mol£»
£Ø2£©¢ŁÓɵēĄė·½Ļņ£¬æÉÖŖcĪŖÕż¼«”¢dĪŖøŗ¼«£¬øŗ¼«ÉĻŹĒ¼×Ķ鏧Ȅµē×Ó£¬ÓėY2O3µÄZrO2¹ĢĢå“«µ¼µÄO2-½įŗĻĪŖ¶žŃõ»ÆĢ¼ÓėĖ®£¬µē¼«·“Ó¦Ź½ĪŖ£ŗCH4-8e-+4O2-=CO2+2H2O£¬
¹Ź“š°øĪŖ£ŗCH4-8e-+4O2-=CO2+2H2O£»
¢ŚŅŅĪŖµē½ā³Ų£¬×Ü·“Ó¦Ź½ĪŖ£ŗ2NaCl+2H2O$\frac{\underline{\;µē½ā\;}}{\;}$2NaOH+H2”ü+Cl2”ü£¬aµē¼«ĪŖŅõ¼«£¬Éś³ÉĘųĢåĪŖĒāĘų£¬ĘäĪļÖŹµÄĮæĪŖ$\frac{0.112L}{22.4L/mol}$=0.005mol£¬ŌņµĆµ½NaOHĪŖ0.005mol”Į2=0.01mol£¬¹ŹNaOHÅضČĪŖ$\frac{0.01mol}{0.1L}$=0.1mol/L£¬ČÜŅŗÖŠĒāĄė×ÓÅضČĪŖ$\frac{1{0}^{-14}}{0.1}$mol/L=10-13mol/L£¬ČÜŅŗpH=-lgc£ØH+£©=-lg10-13=13£¬
¹Ź“š°øĪŖ£ŗ13£»
£Ø3£©¢ŁÓɱķÖŠŹż¾ŻæÉÖŖ£¬ĖęĪĀ¶ČÉżøߣ¬Ę½ŗāĘųĢå×ÜÅضČŌö“ó£¬ĖµĆ÷ÉżøßĪĀ¶ČĘ½ŗāÕżĻņŅĘ¶Æ£¬Õż·“Ó¦ĪŖĪüČČ·“Ó¦£¬Ōņ”÷H£¾0£¬¹Ź“š°øĪŖ£ŗ£¾£»
¢ŚA£®Ī“ÖøĆ÷ÕżÄę·“Ó¦ĖŁĀŹ£¬²»ÄÜĖµĆ÷µ½“ļ£¬¹ŹA“ķĪó£»
B£®ĆܱÕČŻĘ÷ÖŠĘųĢå×ÜŃ¹Ēæ²»±ä£¬ĖµĆ÷»ģŗĻĘųĢå×ÜĪļÖŹµÄĮæ²»±ä£¬·“Ó¦µ½“ļĘ½ŗā£¬¹ŹBÕżČ·£»
C£®ĆܱÕČŻĘ÷ÖŠ»ģŗĻĘųĢåµÄĆÜ¶Č²»±ä£¬ĖµĆ÷»ģŗĻĘųĢå×ÜÖŹĮæ²»±ä£¬·“Ó¦µ½“ļĘ½ŗā£¬¹ŹCÕżČ·£»
D£®ĆܱÕČŻĘ÷ÖŠ°±ĘųµÄĢå»ż·ÖŹż²»±äŹ¼ÖÕ²»±ä£¬ĪŖ¶ØÖµ£¬²»ÄÜĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹD“ķĪó£¬
¹ŹŃ”£ŗBC£»
¢Ū»ģŗĻĘųĢåÖŠNH3£Øg£©”¢CO2£Øg£©ĪļÖŹµÄĮæÖŠĪŖ2£ŗ1£¬Ōņ25”ꏱ£¬c£ØNH3£©=$\frac{2}{3}$”Į4.8”Į10-3mol/L=3.2”Į10-3mol/L£¬c£ØCO2£©=1.6”Į10-3mol/L£¬¹ŹøĆĪĀ¶ČĻĀK=c2£ØNH3£©”Įc£ØCO2£©=£Ø3.2”Į10-3mol/L£©2”Į1.6”Į10-3mol/L”Ö1.64”Į10-8£Ømol/L£©3£¬¹Ź“š°øĪŖ£ŗ1.64”Į10-8£Ømol/L£©3£»
£Ø4£©»ģŗĻŅŗpH=11£¬Ōņc£ØOH-£©=10-3mol/L£¬øł¾ŻKsp[Mg£ØOH£©2]=c2£ØOH-£©”Įc£ØMg2+£©=1.8”Į10-11£¬æÉÖŖc£ØMg2+£©=1.8”Į10-5mol/L£¬¹Ź“š°øĪŖ£ŗ1.8”Į10-5mol/L£®
µćĘĄ ±¾Ģāæ¼²éČČ»Æѧ·½³ĢŹ½ŹéŠ“”¢Ōµē³ŲÓėµē½āŌĄķ”¢»ÆŃ§Ę½ŗāÓ°ĻģŅņĖŲ”¢Ę½ŗāדĢ¬ÅŠ¶Ļ”¢Ę½ŗā³£Źż¼ĘĖć”¢ČܶȻżÓŠ¹Ų¼ĘĖć£¬ĢāÄæ±Č½Ļ×ŪŗĻ£¬ŹĒ¶Ōѧɜ×ŪŗĻÄÜĮ¦µÄ漲飬ÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŃĪĖį | B£® | NaCl | C£® | AgNO3 | D£® | KNO3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĖüÓėŅŅĻ©æÉÄÜŹĒĶ¬ĻµĪļ | |
| B£® | Ņ»ĀČ“śĪļÖ»ÓŠŅ»ÖÖ | |
| C£® | ·Ö×Ó½į¹¹ÖŠ¼×»łµÄŹżÄææÉÄÜŹĒ0”¢1”¢2 | |
| D£® | µČÖŹĮæµÄCH4ŗĶC4H8£¬·Ö±šŌŚŃõĘųÖŠĶźČ«Č¼ÉÕ£¬CH4µÄŗÄŃõĮæŠ”ÓŚC4H8 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹żĮæSO2ĶØČėNaOHČÜŅŗÖŠ·¢ÉśSO2+2OH-ØTSO32-·“Ó¦ | |
| B£® | BF3·Ö×ÓÖŠĖłÓŠŌ×Ó¶¼Āś×ć×īĶā²ć8µē×Ó½į¹¹ | |
| C£® | ijŌŖĖŲŌ×ÓµÄ×īĶā²ćÖ»ÓŠ2øöµē×Ó£¬ŌņøĆŌŖĖŲŅ»¶ØŹĒ¢ņA×åŌŖĖŲ | |
| D£® | Ź¹Ę·ŗģČÜŅŗĶŹÉ«£¬¼ÓČČŗóÓÖ³öĻÖŗģÉ«µÄŹµŃéÄÜÖ¤Ć÷SO2ĘųĢåµÄ“ęŌŚ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | TiCl4ŌŚ·“Ó¦IÖŠŹĒ»¹Ō²śĪļ£¬ŌŚ·“Ó¦¢ņÖŠŹĒŃõ»Æ¼Į | |
| B£® | C”¢MgŌŚ·“Ó¦ÖŠ¾łĪŖ»¹Ō¼Į£¬±»Ńõ»Æ | |
| C£® | ĆæÉś³É19.2 g Ti£¬·“Ó¦¢ń”¢¢ņÖŠ¹²×ŖŅĘ1.6 mol e- | |
| D£® | ·“Ó¦IÖŠb=c=2£¬·“Ó¦IIÖŠMgµÄ»¹ŌŠŌ“óÓŚTi |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ū | B£® | ¢Ł¢Ū¢Ü | C£® | ¢Ś¢Ū¢Ü | D£® | ¢Ł¢Ś¢Ū¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | K+”¢Ba2+”¢Cl-”¢SO42- | B£® | NH4+”¢HCO3-”¢Cl-”¢K+ | ||
| C£® | Cl-”¢Na+”¢NO3-”¢Ca2+ | D£® | Fe2+”¢NO3-”¢I-”¢Cl- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ĪļÖŹ | »ÆѧŹ½ | ČŪµć/”ę | ·Šµć/”ę | ĆܶČ/g£®cm-3 | ŌŚĖ®ÖŠČܽā¶Č |
| ¼× | C3H6O2 | -98 | 57.5 | 0.93 | æÉČÜ |
| ŅŅ | C4H8O2 | -84 | 88 | 0.90 | æÉČÜ |
| A£® | ŻĶČ” | B£® | Õō·¢ | C£® | ÕōĮó | D£® | ·ÖŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µČÖŹĮæµÄĮņÕōĘųŗĶĮņ»Ē·Ö±šĶźČ«Č¼ÉÕ£¬¶žÕ߷ųöµÄČČĮæŅ»Ńł¶ą | |
| B£® | ĒāĘųµÄČ¼ÉÕČČĪŖ285.8kJ/mol£¬ŌņĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ2H2£Øg£©+O2£Øg£©ØT2H2O£Øl£©”÷H=-285.8 kJ/mol | |
| C£® | 2H2£Øg£©+O2£Øg£©ØT2H2O£Øl£©”÷H=-Q1 kJ/mol 2H2£Øg£©+O2£Øg£©ØT2H2O£Øg£©”÷H=-Q2 kJ/mol£¬ŌņQ1£¾Q2 | |
| D£® | ŅŃÖŖÖŠŗĶČČĪŖ57.3 kJ/mol£¬Čō½«ŗ¬0.5molH2SO4µÄÅØČÜŅŗÓėŗ¬1molNaOHµÄČÜŅŗ»ģŗĻ£¬·Å³öµÄČČĮæµČÓŚ57.3kJ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com