
【题目】25℃时,向V mL pH=a的盐酸中,滴加10V mL pH=b的NaOH溶液,所得溶液中Cl-的物质的量恰好等于Na+的物质的量,则a+b的值是
A. 15 B. 14 C. 13 D. 不能确定
科目:高中化学 来源: 题型:
【题目】一支50 mL酸式滴定管中盛有溶液,液面恰好在10.00 mL刻度处,把滴定管中的溶液全部流下排出盛接在量筒中,量筒内溶液的体积是( )
A.大于40.00 mLB.40.00 mLC.大于10.00 mLD.10.00 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。回答下列问题:
(1)肼(N2H4)是一种良好的火箭燃料,拉希格法是制备肼的传统方法,该方法是在5℃条件下,NaClO与NH3反应生成NH2Cl与NaOH,然后在140℃左右的条件下,将上述反应后混合物与氨混合,反应生成肼。上述两步反应中,氧化产物是______________(写化学式)。
(2)机动车尾气已成为城市大气的主要污染源,机动车尾气中的主要有害物质为氮的氧化物。目前科技工作者正在探索用甲烷等燃料气体将氮氧化物还原为N2和水,涉及到的反应有:
CH4(g)+4NO2(g)4NO(g)+CO2(g)+2H2O(g) ΔH1=574 kJ·mol1
CH4(g)+2NO2(g)CO2(g)+2H2O(g)+N2(g) ΔH2=867 kJ·mol1
写出CH4还原NO生成N2的热化学方程式:____________________________。
(3)变质的蔬菜类食物中含有亚硝酸盐,一定温度下,形成该盐的亚硝酸(HNO2)的电离常数Ka=4.0×104。在20 mL 0.01 mol·L1的亚硝酸中逐滴滴加0.01 mol·L1的NaOH溶液,测得混合液的pH变化如图,则图中a点的值为______,b点溶液呈酸性,其原因是__________________,d点溶液呈碱性,原因是______________________________。(已知lg2≈0.3)

(4)工业合成氨的反应原理为:N2(g)+ 3H2 (g)![]() 2NH3(g) ΔH=a kJ·mol1。保持反应体系的容积不变,在其中加入一定量的H2和N2,体系中各物质浓度随时间变化如图所示:
2NH3(g) ΔH=a kJ·mol1。保持反应体系的容积不变,在其中加入一定量的H2和N2,体系中各物质浓度随时间变化如图所示:

①若上述反应体系的容积为2 L,则0~20 min时间内,ν(H2)= ______________,该过程中放出的热量为94.4 kJ,则a=______________。
②25 min时将NH3从反应体系中完全分离出去,45 min时改变温度,在原图中画出25 min~60 min的NH3浓度变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应 A(g)+ 3B(g)2C(g)达到平衡的标志是
A.C 的生成速率与 B 的生成速率相等
B.单位时间生成 nmolA,同时生成 3nmolB
C.A、B、C 的浓度不再变化
D.A、B、C 的分子数比为 1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚β羟丁酸作为一种天然高分子聚合物,具有生物相容性、生物可降解性、无免疫原性和组织相容性等特殊功能,在药物缓释控释系统、骨科以及医用手术缝合线领域有广泛的应用。以A为原料合成聚β羟丁酸的路线如下图:

已知:①芳香环在钠和醇的液氨溶液中能够被还原成1,4环己二烯;
② ;
;
③![]() 。
。
回答下列问题:
(1)A的分子式是__________。下列关于芳香烃的结构与性质的说法正确的是_______(填标号)。
a.芳香烃均含苯环,含苯环的有机物均为芳香烃
b.芳香烃均能发生加成反应
c.芳香烃都不能使酸性KMnO4溶液褪色
d.部分芳香烃能使溴的CCl4溶液褪色
(2)D的化学名称是_________。
(3)B结构简式是_________,C中含有的官能团是__________________。
(4)D生成E的化学方程式是___________________________,该反应的反应类型是_________。
(5)试剂X的同分异构体满足下列条件的共有_________种(不含立体异构)。
①遇FeCl3溶液有显色反应;②能与NaHCO3反应放出CO2。
其中核磁共振氢谱显示为5组峰,且峰面积比为1∶1∶2∶2∶2的是___________(写结构简式)。
(6)参照上述合成路线,以间二甲苯( )为原料(无机试剂任选),设计环酯
)为原料(无机试剂任选),设计环酯 的合成路线:____________________________________。
的合成路线:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置不能达到有关实验目的是
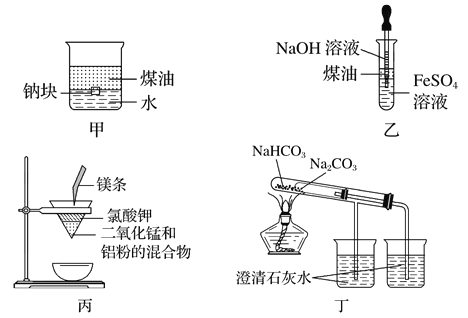
A. 用甲图装置证明密度ρ(煤油)<ρ(钠)<ρ(水)
B. 用乙图装置制备Fe(OH)2
C. 用丙图装置制取金属锰
D. 用丁图装置比较NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其合金的说法不正确的是( )
A. 目前我国流通的硬币是由合金材料制造的
B. 所有合金材料那具有较强的抗腐蚀能力
C. 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D. 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式_________________________。
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As。(填“>”或“<”)
(3)AsCl3分子的立体构型为______________,其中As的杂化轨道类型为__________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGapm和rAspm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_____________。(已知:晶胞内As原子之间彼此不相切)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com