
| A. | ①③⑤ | B. | ④⑤⑥ | C. | ②③④ | D. | ②④⑥ |
分析 ①碱性氧化物是和酸反应生成盐和水的氧化物,酸性氧化物是指和碱反应生成盐和水的氧化物,发生的反应都是复分解反应生成的盐为一种;
②由阴阳离子构成的化合物为离子化合物;
③电解质是指在水溶液中或熔融状态下能够导电的化合物,水溶液中能完全电离的电解质为强电解质,水溶液中部分电离的电解质为弱电解质;非电解质是指在水溶液中和熔融状态下能够导电的化合物;
④酸指电离时所有阳离子都是氢离子的化合物;碱指电离时所有阴离子都是氢氧根离子的化合物;盐指由金属阳离子和酸根阴离子构成的化合物;两种元素组成其中一种是氧元素的化合物;
⑤NaHCO3是发酵粉主要成分之一俗称小苏打,可冶疗胃酸过多,碳酸钠碱性强不能用来治疗胃酸过多;
⑥不同物质组成的为混合物,同一种物质组成的为纯净物.
解答 解:①Fe2O3和酸反应生成盐和水属于碱性氧化物,A12O3 和酸、碱反应生成盐和水属于两性氧化物,CO2能和碱溶液发生反应属于酸性氧化物,NO2都和碱反应生成盐和水发生的是氧化还原反应,不是酸性氧化物,故①错误;
②碳酸钠是钠离子和碳酸根离子构成,氢氧化钡是钡离子和氢氧根离子构成,氯化铵是铵根离子和氯离子构成,过氧化钠是钠离子和过氧根离子构成,都属于离子化合物,故②正确;
③蔗糖水溶液中和熔融状态都不导电的化合物属于非电解质,硝酸钾溶于水完全电离属于强电解质,硫酸钡难溶于水但熔融状态完全电离导电,属于强电解质,故③错误;
④醋酸属于酸,烧碱是氢氧化钠属于碱,纯碱是碳酸钠属于盐,生石灰为氧化钙属于氧化物,故④正确;
⑤NaHCO3俗称小苏打,是发酵粉主要成分之一,Na2CO3碱性强腐蚀性强,不能冶疗胃酸过多,应用碳酸氢钠治疗胃酸过多,故⑤错误;
⑥盐酸是氯化氢的水溶液属于混合物,而液氯、冰醋酸均是一种物质组成属于纯净物,故⑥正确;
故选D.
点评 本题考查了物质分类、物质组成的应用,难度不大,掌握物质的组成和化学概念实质是解题的关键.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:实验题
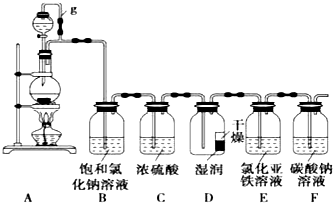 某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题:
某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | $\frac{{c({H^+})}}{{c(O{H^-})}}={10^{-10}}$的溶液:K+、Ba2+、NO3-、Cl- | |
| C. | pH=0的溶液:Al3+、Cl-、SO42-、CO32- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、I-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.
海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.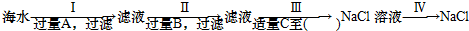
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 18gH2O含有的氢分子数目为NA | |
| B. | 标准状况下,22.4LCCl4含有的分子数目为NA | |
| C. | 1L 1mol•L-1K2SO4溶液中含有的钾离子数目为NA | |
| D. | 1mol Fe与足量的稀盐酸反应,失去的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
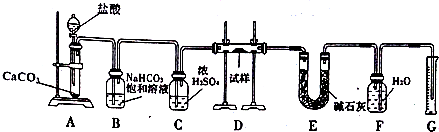
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Z2- | |
| C. | 同主族元素中Z的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com