
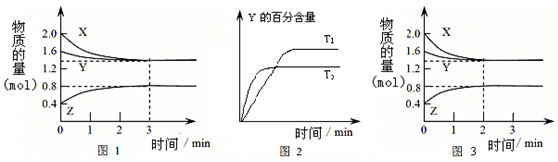
| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 0~3min内,v(X)=0.1 mol/(L•min) | |
| C. | 达平衡后,升高温度,v正、v逆都增大,且再次平衡前v正<v逆 | |
| D. | 若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强 |
分析 A、根据物质的量的变化量与化学计量数成正比书写化学方程式;
B、根据3min内X的物质的量浓度的变化量计算化学反应速率;
C、根据图2中曲线的斜率大小判断,T2时先到达平衡状态,说明反应速率大,根据温度越高反应速率越大说明T2温度高,温度升高时Y的百分含量降低,说明平衡向正反应方向移动,正反应是吸热反应;
D、图3与图1比较,判断平衡是否发生移动,根据影响平衡移动的因素判断.
解答 解:A、根据图1分析,反应中X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,所以X、Y为反应物,Z为生成物,由于该反应反应物没有完全反应,该反应为可逆反应,根据物质的量的变化量与化学计量数成正比可知0.6mol:0.2mol:0.4mol=3:1:2,所以反应的化学方程式为3X(g)+Y(g)?2Z(g),故A正确;
B、反应进行的前3min内,v(X)=$\frac{0.6mol}{2L×3min}$=0.1mol/(L•min),故B正确;
C、根据图2中曲线的斜率大小判断,T2时先到达平衡状态,说明反应速率大,根据温度越高反应速率越大说明T2温度高,温度升高时Y的百分含量降低,说明平衡向正反应方向移动,正反应是吸热反应,所以v正、v逆都增大,且再次平衡前v正>v逆,故C错误;
D、图3与图1比较,图3到达平衡所用的时间较短,说明反应速率增大,但平衡状态没有发生改变,应是加入催化剂所致,故D错误.
故选CD.
点评 本题考查化学平衡移动以及平衡图象题,做题时注意分析图象中曲线的变化规律,结合外界条件对平衡移动的影响进行分析,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑥⑦ | B. | ②⑤⑥⑦ | C. | ①③④⑤⑧ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇可作为燃料电池的原料.通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为20L.
甲醇可作为燃料电池的原料.通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为20L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
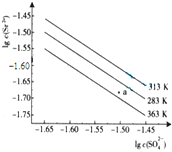
| A. | 温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小 | |
| B. | 三个不同温度中,313K时Ksp(SrSO4)最小 | |
| C. | 283K时,图中a点对应的溶液是不饱和溶液 | |
| D. | 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某兴趣小组设计如下微型实验装置.实验时,先断开 K2,闭合 K1,两极均有气泡产生; 一段时间后,断开 K1,闭合 K2,发现电流表指针偏转,下列有关描述正确的是( )
某兴趣小组设计如下微型实验装置.实验时,先断开 K2,闭合 K1,两极均有气泡产生; 一段时间后,断开 K1,闭合 K2,发现电流表指针偏转,下列有关描述正确的是( )| A. | 断开 K2,闭合 K1时,总反应的离子方程式为:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑ | |
| B. | 断开 K2,闭合 K1时,石墨电极附近溶液变红 | |
| C. | 断开 K1,闭合 K2时,铜电极上的电极反应为:Cl2+2e-=2Cl- | |
| D. | 断开 K1,闭合 K2 时,石墨电极作正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼烧的铁丝在氯气中燃烧,集气瓶内充满棕黄色烟雾 | |
| B. | 氢气在氯气中燃烧,集气瓶口有白雾 | |
| C. | 向盛水的烧杯中先加入过氧化钠,再滴加酚酞,最终溶液呈红色 | |
| D. | 将Cl2通入紫色石蕊溶液中,溶液变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
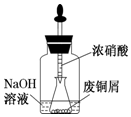 由废铜制硝酸铜.用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.
由废铜制硝酸铜.用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com