
鉴别NaCl、NaBr、NaI可以选用的试剂是( )
①碘水、淀粉溶液 ②氯水、CCl4 ③溴水、苯 ④稀硝酸、AgNO3溶液 ⑤氯水、苯 ⑥FeCl3溶液、CCl4
A.①②④ B.②③⑥
C.②④⑤ D.④⑤⑥
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
合金与纯金属制成的金属材料相比,优点是( )
①合金的硬度一般比它的各成分金属的大
②一般地,合金的熔点比它的各成分金属的更低
③改变原料的配比、改变生成合金的条件,得到有不同性能的合金
④合金比纯金属的导电性更强
⑤合金比纯金属的应用范围更广泛
A.②③④ B.①②③⑤
C.①②④ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
高考选项正误判断,正确的打“√”,错误的打“×”
(1)SiO2、NaOH、HF三者两两均能反应( )
(2014·江苏,8C改编)
(2)Si和SiO2都用于制造光导纤维( )
(2014·海南,10D)
(3)硅胶可作袋装食品的干燥剂( )
(2014·四川理综,1B)
(4)SiO2既能与KOH溶液反应又能与浓盐酸反应( )
(2014·福建理综,9②改编)
(5)甲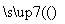 乙
乙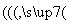 丙,若甲为焦炭,则丁可能是O2( )
丙,若甲为焦炭,则丁可能是O2( )
(2013·江苏,6A)
(6)合成纤维和光导纤维都是新型无机非金属材料( )
(2012·新课标全国卷,8D)
(7)SiO2可与HF反应,因而氢氟酸不能保存在玻璃瓶中( )
(2013·广东理综,10D)
(8)高温下用焦炭还原SiO2制取粗硅( )
(2013·广东理综,11C)
(9)硅酸钠溶液应保存在带玻璃塞的试剂瓶中( )
(2012·海南,4B)
(10)水玻璃可用于生产黏合剂和防火剂( )
(2010·江苏,4B)
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物在自然界广泛存在并被人类应用。
(1)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。可以用NH3和SiH4(硅烷)在一定条件下反应,并在600 T的加热基板上生成氮化硅膜:
3SiH4+4NH3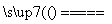 Si3N4+12H2
Si3N4+12H2
以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si 4NH3↑+SiH4↑+2MgCl2 ΔH<0
4NH3↑+SiH4↑+2MgCl2 ΔH<0

①NH4Cl中的化学键类型有______________________,SiH4的电子式为______________。
②上述生产硅烷的过程中液氨的作用是_______________________________________
________________________________________________________________________。
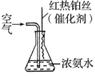
③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式________________________________________________________________________,
实验室可利用如右图所示装置完成该反应。在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是______________。
(2)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为__________________________________________。将0.184 g三硅酸镁加入
到50 mL 0.1 mol·L-1盐酸中,充分反应后,滤去沉淀,用0.1 mol·L-1 NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8·nH2O中n的值为__________。(注:Mg2Si3O8的摩尔质量为260 g·mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用下列两种方法制氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。所得的氯气( )
A.①比②多 B.②比①多
C.一样多 D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
氢溴酸在医药和石化工业上有广泛用途。模拟工业制备氢溴酸的流程如图所示:

回答下列问题:
(1)混合①中发生反应的离子方程式为_________________________________________
________________________________________________________________________。
(2)混合②中加入试剂a是________________________。
(3)加入Na2SO3的目的是除去过量的Br2,但要防止过量,原因是____________________________(请用离子方程式表示)。
(4)工业氢溴酸常带有淡淡的黄色,可能的原因是:①含Fe3+,②含Br2,③含Fe3+和Br2,只用下列一种试剂就能分析产生淡黄色的原因。该试剂是____(填字母)。
a.KMnO4溶液 b.NaOH溶液
c.KSCN溶液 d.淀粉KI溶液
e.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,在A处通入氯气,关闭B阀时,C处干燥的红布条看不到明显现象;当打开B阀后,C处干燥的红布条逐渐褪色。则D瓶中盛放的溶液不可能是( )
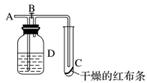
A.浓硫酸
B.NaOH溶液
C.饱和Na2SO3溶液
D.饱和氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿,现把白锡制成的器皿放在0 ℃、100 kPa的室内存放,它会不会变成灰锡而不能再继续使用?
已知:在0 ℃、100 kPa条件下白锡转化为灰锡的反应焓变和熵变分别为ΔH=-2 180.9 J·mol-1,ΔS=-6.61 J·mol-1·K-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是
C8H10(g)C8H8(g)+H2(g) ΔH=125 kJ·mol-1
Ⅰ.某温度下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20 min时,该段时间内H2的平均反应速率是________。
(2)该温度下,该反应的化学平衡常数是____________。
(3)若保持其他条件不变,用0.40 mol H2(g)和0.40 mol C8H8(g)合成C8H10(g),当有30 kJ热量放出时,该反应中H2的转化率是________________。此时,该反应是否达到了平衡状态?________(填“是”或“否”)。
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。
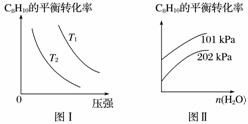
(4)由图Ⅰ可知,T1________T2(填“大于”、“小于”或“等于”)。
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将________(填“越大”、“越小”或“不变”),原因是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com