
【题目】用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是

A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl-+ 2OH--2e-= ClO-+ H2O
C. 阴极的电极反应式为:2H2O + 2e-= H2↑ + 2OH-
D. 除去CN-的反应:2CN-+ 5ClO-+ 2H+= N2↑ + 2CO2↑ +5Cl-+ H2O
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4KJ/mol。在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图所示:
2NH3(g) ΔH=-92.4KJ/mol。在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图所示:
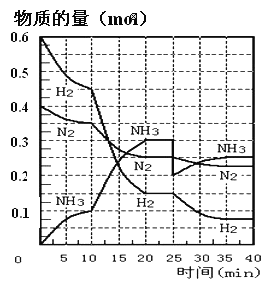
(1)10min内用NH3表示该反应的平均速率,v(NH3)= _______。
(2)在10-20min内NH3浓度变化的原因可能是_______(填字母)。
a.加了催化剂 b.降低温度 c.增加NH3的物质的量
(3)该可逆反应达到平衡的标志是___(填字母)
a.3v(H2)正=2v(NH3)逆
b.混合气体的密度不再随时间变化
c.容器内的总压强不再随时间而变化
d.N2、H2、NH3的分子数之比为1:3:2
e.单位时间生成mmolN2的同时消耗3mmolH2
f.amolN=N键断裂的同时,有6amolN-M键合成
(4)第一次平衡时,平衡常数K1=____(用数学表达式表示)。NH3的体积分数是_____(保留2位小数)。
(5)在反应进行到25min时,曲线发生变化的原因是______。
(6)已知:N2(g)+3H2![]() 2NH3(g) ΔH=-92.4KJ/mol
2NH3(g) ΔH=-92.4KJ/mol
2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6KJ/mol
2H2O(g) ΔH=-483.6KJ/mol
氨气完全燃烧生成气态水的热化学方程式是______
(7)安阳燃料电池具有很大的发展潜力。安阳燃料电池工作原理如图所示:
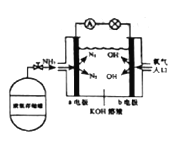
①b电极的电极反应式是_________;
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时加水稀释10 mL pH=11的氨水,下列判断正确的是 ( )
A.原氨水的浓度为10-3mol·L-1
B.溶液中![]() 减小
减小
C.氨水的电离程度增大,溶液中所有离子的浓度均减小
D.再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备四氯化硅液体的装置。已知:四氯化硅熔点为-70℃,沸点57.6℃,遇水极易反应。

请回答下列问题。
(1)写出装置A中发生反应的化学方程式_______________________________
(2)装置B中盛放的试剂是____________;装置C的作用是___________
(3)g管的作用是_________________________________
(4)装置E中冰水的作用是_________________________________________
(5)干燥管F中碱石灰的作用是___________________和________________________
(6)若要用装置B、C代替装置F,则装置B、C中应盛放的试剂分别是_____、__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①向0.1 mol·L-1 CH3COOH溶液中加入少量冰醋酸,平衡向正反应方向移动,电离程度增大;
②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同;
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积
A.①②④ B.②④ C.②③ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数由小到大排列的五种短周期元素,其中A、B、C、D的原子序数之和为32,A是元素周期表中原子半径最小的元素,B、C左右相邻,C、D位于同主族.
(1)E元素原子的结构示意图为: ,写出一个能证明D、E两元素非金属性强弱的事实或反应方程式: .
(2)A与C组成的化合物的电子式为 ,其中含有的化学键为 (填“极性键”“非极性键”“离子键”).(若有多种可能,只需答出其中一种物质)
(3)A、B、C、D四种元素中的三种能组成一种强酸,该强酸的稀溶液能与铜反应,其中起氧化性作用的酸占消耗酸总物质的量的百分比是 .
(4)由A、B、C、D四种元素组成的一种离子化合物X.
①已知1mol X能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下X与NaOH浓溶液反应的离子方程式: .
②又知X既能与盐酸反应,又能与氯水反应,写出X的化学式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A. 钠燃烧产物为过氧化钠 B. 锂燃烧产物为氧化锂
C. Na2O和Na2O2均属于碱性氧化物 D. Na2O和Na2O2均与CO2反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com