
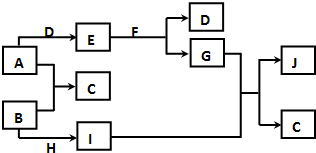
 现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A、H为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀.请回答下列问题:
现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A、H为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀.请回答下列问题:分析 已知通常情况下A、H为固态金属单质,B、D为气态非金属单质,E为淡黄色固体Na2O2,F为无色液体为H2O,J为红褐色沉淀为Fe(OH)3.G为NaOH,D为O2,A为Na,B为Cl2,H为Fe,I为FeCl3,C为NaCl,据此分析问题.
解答 解:已知通常情况下A、H为固态金属单质,B、D为气态非金属单质,E为淡黄色固体Na2O2,F为无色液体为H2O,J为红褐色沉淀为Fe(OH)3.G为NaOH,D为O2,A为Na,B为Cl2,H为Fe,I为FeCl3,C为NaCl,
(1)分析可知物质的化学式A为Na,J为Fe(OH)3,
故答案为:Na;Fe(OH)3;
(2)转化I+G→J+C的反应是FeCl3和G为NaOH溶液反应生成氢氧化铁沉淀,FeCl3+3NaOH=Fe(OH)3↓+3NaCl,反应类型为复分解反应,
故答案为:复分解反应;
(3)①E+F→D+G的反应为过氧化钠和水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
②B+H→I的反应为铁和氯气反应生成氯化铁,反应的化学方程式为:2Fe+3Cl2=2FeCl3,
故答案为:2Fe+3Cl2=2FeCl3;
(4)E物质为过氧化钠,可以做漂白剂、供氧剂等,
故答案为:供氧剂等;
点评 本题考查了物质转化关系的判断、物质性质理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 装有尾气净化装置的汽车排出的气体中不再含有NO或CO | |
| B. | 升温能使反应物活化分子的百分数增加,所以提高尾气净化效率还需要升高温度 | |
| C. | 提高尾气净化效率的最佳途径是研制高效催化剂 | |
| D. | 因该反应正向进行的程度已经很大,故使用催化剂并无实际意义 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 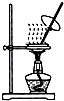 蒸发FeCl3溶液得氯化铁晶体 | |
| B. | 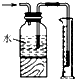 测量氯气的体积 | |
| C. |  作为制取少量SO2的尾气吸收装置 | |
| D. | 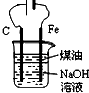 制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠固体保存在配有橡皮塞的细口瓶中 | |
| B. | 将SO2通入品红溶液或KMnO4溶液均能使它们褪色,均可证明有漂白性 | |
| C. | 不能在石英坩埚中熔化氢氧化钠 | |
| D. | 用湿润的pH试纸测定稀盐酸的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
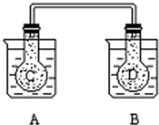 如图所示,25℃时,在烧杯A中装有50.00ml蒸馏水,烧杯B 中盛有50.00
如图所示,25℃时,在烧杯A中装有50.00ml蒸馏水,烧杯B 中盛有50.00查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 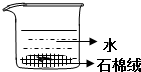 | B. | 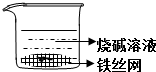 | ||
| C. | 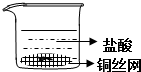 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.08mol•L-1 | B. | 1.37mol•L-1 | C. | 1.54mol•L-1 | D. | 2.48mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com