
【题目】氯气是现代工业的重要原料,将氯化氢转化为氯气的技术成为科学研究的热车点,回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。可按下列催化过程进行:
Ⅰ.CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1
Ⅱ.CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1
Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
反应Ⅰ能自发进行的条件是___。利用ΔH1和ΔH2计算ΔH3时,还需要利用反应___的ΔH。
(2)如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(400℃)__K(500℃)(填“大于”或“小于”)。设容器内初始压强为p0,根据进料浓度比c(HCl):c(O2)=4:1的数据,计算400℃时容器内的平衡压强=___(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2)过低、过高的不利影响分别是___。
(3)已知:氯气与NaOH溶液反应可生成NaClO3。有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-=ClO2-+Cl-
Ⅱ.ClO2-+ClO-=ClO3-+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:___。
(4)电解NaClO3水溶液可制备NaClO4,写出阳极反应式:___。
【答案】高温 CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) 大于 0.848p0 Cl2和O2分离能耗较高、HCl转化率较低 反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化 ClO3-+H2O-2e-=ClO4-+2H+
【解析】
(1)Ⅰ.CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=+83kJ·mol-1,△S>0,则要△G=△H-T△S<0,须高温条件下才能自发;
Cl2(g) ΔH1=+83kJ·mol-1,△S>0,则要△G=△H-T△S<0,须高温条件下才能自发;
Ⅰ.CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1
Ⅱ.CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1
Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
利用ΔH1和ΔH2计算ΔH3时,由盖斯定律,(Ⅲ-Ⅱ×2-Ⅰ×2)/2得:还需要利用反应CuO(s)+2HCl(g)=CuCl2(s)+H2O(g)的ΔH。
故答案为:高温;CuO(s)+2HCl(g)=CuCl2(s)+H2O(g);
(2)根据图象可知,进料浓度比相同时,温度越高HCl平衡转化率越低,说明该反应为放热反应,升高温度平衡向着逆向移动,则温度越高平衡常数越小,所以反应平衡常数K(400℃)大于K(500℃);进料浓度比c(HCl):c(O2)的比值越大,HCl的平衡转化率越低,根据图象可知,相同温度时HCl转化率最高的为进料浓度比c(HCl):c(O2)=4:1,该曲线中400℃HCl的平衡转化率为76%。则

p=![]() p0=0.848p0;
p0=0.848p0;
进料浓度比c(HCl):c(O2)过低时,O2浓度较大,HCl的转化率较高,但Cl2和O2分离能耗较高,生成成本提高;进料浓度比c(HCl):c(O2)过高时,O2浓度较低,导致HCl的转化率减小;
故答案为:大于;p=![]() p0=0.848p0;Cl2和O2分离能耗较高、HCl转化率较低;
p0=0.848p0;Cl2和O2分离能耗较高、HCl转化率较低;
(3)生成NaClO3的反应分两步进行:Ⅰ.2ClO-=ClO2-+Cl-,Ⅱ.ClO2-+ClO-=ClO3-+Cl-,常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,用碰撞理论解释其原因:反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化;
答案为:反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化;
(4)电解NaClO3水溶液可制备NaClO4,阳极发生氧化反应生成ClO4-,阳极反应式:ClO3-+H2O-2e-=ClO4-+2H+。
故答案为:ClO3-+H2O-2e-=ClO4-+2H+。


科目:高中化学 来源: 题型:
【题目】S2Cl2是一种重要的化工产品。常温时是一种有毒并有恶臭的金黄色液体,熔点-76℃,沸点138℃,受热或遇水分解放热,放出腐蚀性烟气,易与水反应,300℃以上完全分解。进一步氯化可得 SCl2, SCl2 是樱桃红色液体,易挥发,熔点-122℃,沸点 59℃。SCl2与 S2Cl2 相似,有毒并有恶臭,但更不稳 定。实验室可利用硫与少量氯气在 110~140℃反应制得 S2Cl2 粗品。
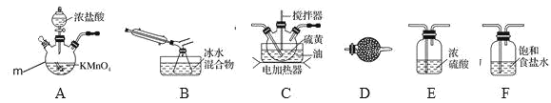
请回答下列问题:
(1)仪器 m 的名称为______,装置 D 中试剂的作用是______。
(2)装置连接顺序:______→B→D。
(3)为了提高 S2Cl2 的纯度,实验的关键是控制好温度和______。
(4)从 B 中分离得到纯净的 S2Cl2,需要进行的操作是______;
(5)若将S2Cl2放入少量水中会同时产生沉淀和两种气体。某同学设计了如下实验方案,测定所得混合气体中某一成分 X 的体积分数:
![]()
①W 溶液可以是______(填标号)。
a H2O2 溶液 b 氯水 c 酸性 KMnO4 溶液 d FeCl3 溶液
②该混合气体中气体 X 的体积分数为______(用含 V、m 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有一定量NaOH溶液中,逐渐通入一定量 CO2,充分反应后,将溶液在一定条件下进行蒸干,得到晶体物质。其质量m 与通入气体体积V(CO2)的关系如图。如下说法正确的是
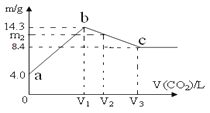
A.晶体物质:a点是NaOH;b点是Na2CO3;c点是NaHCO3
B.a→b 和 b→c 两段过程得到的晶体,含有相同的晶体物质
C.整个过程中的溶液,一定存在恒等式:c(Na+)+c(H+)=c(OH-)+c(CO32-)+c(HCO3-)
D.若通入V2=1.344 L (标况) 气体,则m2=13.12 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:-CHO+(C6H5)3P=CH-R -CH=CH-R + (C6H5)3P=O,R代表原子或原子团,W是一种有机合成中间体,结构简式为:HOOC-CH=CH-CH=CH-COOH,其合成方法如下:
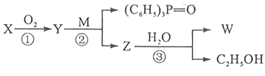
其中,![]() 分别代表一种有机物,合成过程中其他产物和反应条件已略去。
分别代表一种有机物,合成过程中其他产物和反应条件已略去。
X与W在一定条件下反应可以生成酯N,N的相对分子质量为168。
请回答下列问题:
(1)W能发生反应的类型有__________。(填写字母编号)
A.取代反应 | B.水解反应 | C.氧化反应 | D.加成反应 |
(2)写出X与 W在一定条件下反应生成N的化学方程式:___________________。
(3)写出含有3个碳原子且不含甲基的X的同系物的结构简式_________________
(4)写出第②步反应的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某二元弱酸H2A水溶液中逐滴加入NaOH溶液,混合溶液中lgx(x为![]() 或
或![]() )与pH的变化关系如图所示,下列说法正确的是( )
)与pH的变化关系如图所示,下列说法正确的是( )
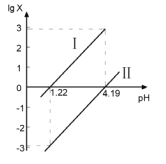
A.pH=7时,存在c(Na+)=c(H2A)+c(HA-)+c(A2-)
B.直线Ⅰ表示的是lg![]() 随pH的变化情况
随pH的变化情况
C.![]() =10-2.97
=10-2.97
D.A2-的水解常数Kh1大于H2A电离常数的Ka2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各对物质中,互为同系物的是( )
A.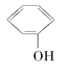 与
与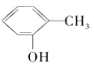
B.HCOOCH3与CH3CH2COOH
C.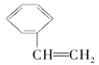 与CH3-CH=CH2
与CH3-CH=CH2
D.C6H5OH与C6H5CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是( )
A.选择合适的试剂,用图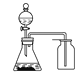 所示装置可分别制取少量CO2、NO和O2
所示装置可分别制取少量CO2、NO和O2
B.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有足量酸性KMnO4溶液、浓硫酸的洗气瓶
C.洗涤沉淀时(如图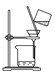 ),向漏斗中加适量水,搅拌并滤干
),向漏斗中加适量水,搅拌并滤干
D.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
A.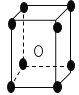 B.
B.
C.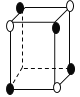 D.
D.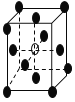
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com