
| A. | 1 mo1H2O分子所含中子数为8NA | |
| B. | 30g乙烷中所含的共价键数为6 NA | |
| C. | 常温下,1LpH=1的H2SO4溶液中,含有H+的数目为0.2 NA | |
| D. | 100 mL0.1mol•L-1的CuCl2溶液中,含有Cu2+的数目为0.01 NA |
分析 A、H原子不含中子,故水分子中含8个中子;
B、求出乙烷的物质的量,然后根据乙烷中含7条共价键来分析;
C、pH=1的硫酸溶液中氢离子浓度为0.1mol/L;
D、铜离子是弱碱阳离子,在溶液中会水解.
解答 解:A、H原子不含中子,故水分子中含8个中子,故1mol水中含8NA个中子,故A正确;
B、30g乙烷的物质的量为1mol,而乙烷中含7条共价键,故1mol乙烷中含有7NA对共用电子对,故B错误;
C、pH=1的硫酸溶液中氢离子浓度为0.1mol/L,故1L此溶液中含有的氢离子的个数为0.1NA个,故C错误;
D、铜离子是弱碱阳离子,在溶液中会水解,故溶液中的铜离子的个数小于0.01NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,56g由N2和CO组成的混合气体含有的原子数目为4 NA | |
| B. | 高温下,0.2 molFe与足量水蒸气反应,生成的H2分子数为0.3NA | |
| C. | 1 L 1.0mol•L-1的NaAlO2水溶液中含有的总原子数为2NA | |
| D. | 1 mol羟基中含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④ | C. | ①④ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
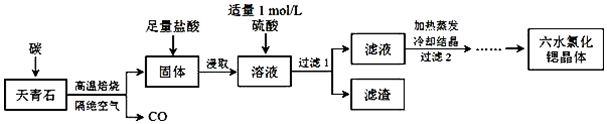
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 用pH试纸检测:0.1mol•L-1Na2SO3溶液、0.1mol•L-1NaHSO3溶液 | Na2SO3溶液的pH约为10; NaHSO3溶液的pH约为5 | HSO3-结合H+的能力比SO32-强 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
| C | 注射器中吸入NO2,封堵针尖处,将注射器体积压缩为原来的一半 | 气体颜色比起始时浅 | 加压后,NO2转变为无色的N2O4 |
| D | 饱和BaSO4悬浊液中加入饱和Na2CO3溶液,振荡,然后过滤、洗涤,向所得固体中加入盐酸 | 沉淀部分溶解且有气体产生 | Ksp(BaSO4)> Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 金属性:Na>Mg | C. | 稳定性:HF>CH4 | D. | 酸性:HF<HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将10%的葡萄糖溶液加入新制氢氧化铜悬浊液中,加热可得到砖红色沉淀 | |
| B. | 苯加入到溴水中,苯和溴发生取代反应而使溴水褪色 | |
| C. | 在洁净的试管中加入1~2 mL AgNO3溶液,再滴加稀氨水,直到AgOH完全沉淀,即制得银氨溶液 | |
| D. | 在空气中灼烧铜丝,待铜丝冷却后伸入乙醇中,反复多次,可以制得乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、C、D三种元素形成的化合物一定是共价化合物 | |
| B. | 工业上常用电解E与F形成的化合物的方法制取单质E | |
| C. | 原子半径由大到小的顺序:D>C>B>A | |
| D. | B、C、F元素最高价氧化物水化物酸性最强的是F |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com