
分析 (1)反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)?CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1
根据盖斯定律,反应Ⅱ=反应Ⅰ-反应Ⅲ,故△H2=△H1-△H3;
反应Ⅲ为熵减的反应,△G=△H-T△S<0反应自发进行;
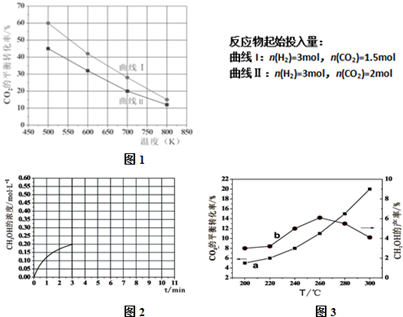
(2)A.由曲线I可知,n(H2)=3mol,n(CO2)=1.5mol,650K 时二氧化碳的转化率小于40%;
B.n(H2)=3mol,n(CO2)=2mol,550K时二氧化碳转化率小于40%,但接近40%,再移走0.3mol二氧化碳等效为选项中的平衡,二氧化碳的转化率会增大;
C.n(H2)=3mol,n(CO2)=1.5mol,650K时二氧化碳转化率小于40%,再加入0.4mol二氧化碳等效为选项中的平衡,二氧化碳的转化率会减小;
D.n(H2)=3mol,n(CO2)=2mol,550K时二氧化碳转化率小于40%,再加入1mol二氧化碳等效为选项中的平衡,二氧化碳的转化率会减小;
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡,平衡时二氧化碳的转化率为60%,则转化的二氧化碳为1.5mol×60%=0.9mol,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol):1.5 3 0 0
变化量(mol):0.9 2.7 0.9 0.9
平衡量(mol):0.6 0.3 0.9 0.9
a.根据v=$\frac{△c}{△t}$计算用H2表示该反应的速率;
b.计算平衡浓度,代入平衡常数表达式K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$计算;
c.3min时未到达平衡,此时迅速将体系温度升至600K,瞬间甲醇的浓度不变,反应速率加快,到达平衡的时间小于10min,而在温度为600K的条件下,充入3mol H2和1.5mol CO2,平衡时二氧化碳的转化率约是42%,则平衡时甲醇的物质的量约是1.5mol×42%=0.63mol,则平衡时甲醇的浓度约是0.315mol/L;
(3)①A.改用高效催化剂不影响平衡的移动;
B.升高温度,加快反应速率且使得平衡逆向移动;
C.缩小容器体积,增大压强,加快反应速率且使得平衡正向移动;
D.分离出甲醇,不能加快反应速率误;
E.增加CO2的浓度,可以加快反应速率且使得平衡正向移动;
②反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO,所以当温度高于260℃后,CO的浓度一定增大.
解答 解:(1)反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)?CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1
根据盖斯定律,反应Ⅱ=反应Ⅰ-反应Ⅲ,故△H2=△H1-△H3=49.58kJ•mol-1)-(-90.77kJ•mol-1)=+41.19 kJ•mol-1,
反应Ⅲ为熵减的反应,△S<0,反应自发进行,则△G=△H-T△S<0,故要自发进行需要在较低温下进行,
故答案为:+41.19 kJ•mol-1;较低温;
(2)①A.由曲线I可知,n(H2)=3mol,n(CO2)=1.5mol,650K 时二氧化碳的转化率小于40%,故A错误;
B.n(H2)=3mol,n(CO2)=2mol,550K时二氧化碳转化率小于40%,但接近40%,再移走0.3mol二氧化碳等效为选项中的平衡,二氧化碳的转化率会增大,可能大于40%,故B正确;
C.n(H2)=3mol,n(CO2)=1.5mol,650K时二氧化碳转化率小于40%,再加入0.4mol二氧化碳等效为选项中的平衡,二氧化碳的转化率会减小,故C错误;
D.n(H2)=3mol,n(CO2)=2mol,550K时二氧化碳转化率小于40%,再加入1mol二氧化碳等效为选项中的平衡,二氧化碳的转化率会减小,故D错误;
故选:B;
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡,平衡时二氧化碳的转化率为60%,则转化的二氧化碳为1.5mol×60%=0.9mol,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol):1.5 3 0 0
变化量(mol):0.9 2.7 0.9 0.9
平衡量(mol):0.6 0.3 0.9 0.9
a.氢气表示的反应速率=$\frac{\frac{2.7mol}{2L}}{10min}$=0.135 mol•L-1•min-1,故答案为:0.135 mol•L-1•min-1;
b.该温度下,反应I的平衡常数K=$\frac{\frac{0.9}{2}×\frac{0.9}{2}}{\frac{0.6}{2}×(\frac{0.3}{2})^{3}}$=200,故答案为:200;
c.3min时未到达平衡,此时迅速将体系温度升至600K,瞬间甲醇的浓度不变,反应速率加快,到达平衡的时间小于10min,而在温度为600K的条件下,充入3mol H2和1.5mol CO2,平衡时二氧化碳的转化率约是42%,则平衡时甲醇的物质的量约是1.5mol×42%=0.63mol,则平衡时甲醇的浓度约是0.315mol/L,3~10min内容器中CH3OH浓度的变化趋势曲线为: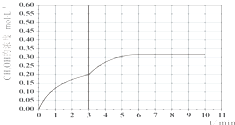 ,
,
故答案为: ;
;
(3)①A.改用高效催化剂,能加快反应速率,缩短到达平衡的水解,但是不影响平衡的移动,甲醇生产量不变,故错误;
B.升高温度,加快反应速率,正反应为放热反应,平衡逆向移动,甲醇生产量减小,故B错误;
C.缩小容器体积,增大压强,加快反应速率,平衡正向移动,甲醇生产量增大,故C正确;
D.分离出甲醇,平衡正向移动,甲醇生产量增大,但反应速率减慢,故C错误;
E.增加CO2的浓度,可以加快反应速率且使得平衡正向移动,甲醇生产量增大,故E正确,
故选:CE;
②反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO,所以当温度高于260℃后,CO的浓度一定增大,
故答案为:增大;反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO,综上所述,CO的浓度一定增大.
点评 本题综合考查化学平衡计算、盖斯定律的应用、化学反应速率的计算、化学平衡移动的影响因素等知识,需要学生具备扎实的基础与分析解决问题的能力,难度中等.


 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | b>f | |
| B. | 平衡常数K(1000℃)<K(810℃) | |
| C. | 915℃,2.0MPa该反应的平衡常数为Kp=4.5MPa | |
| D. | 1000℃,3.0MPa时E的转化率为83% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当金属全部溶解时收集到NO气体的体积一定为2.24 L | |
| B. | 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100mL | |
| C. | 参加反应的金属的总质量3.6g<m<9.6 g | |
| D. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液和稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 碳酸钾溶液与稀硫酸反应:CO32-+H+═CO2↑+H2O | |
| C. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 实验室制取氧气:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2K++2Cl-+3O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1NaHCO3溶液中的Na+数为NA | |
| B. | 常温时,4.4gCO2所含的氧原子数为0.2NA | |
| C. | 5.6g Fe与足量稀硝酸反应,转移电子数为0.2NA | |
| D. | 1molNa 与O2 反应生成Na2O2和Na2O电子转移数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入过量的氨水中:SO2+NH3•H2O═NH4++HSO3- | |
| B. | FeO溶于过量稀硝酸中:FeO+2H+═Fe2++H2O | |
| C. | NH4Al(SO4)2溶液中加入过量NaOH溶液中:NH4++Al3++4OH-═NH3•H2O+Al(OH)3↓ | |
| D. | 铜溶于酸化的H2O2溶液中:Cu+H2O2+2H+═Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com