
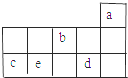
 a、b、c、d、e为元素周期表前3周期中的部分元素,它们在元素周期表中的相对位置如图所示.下列叙述正确的是( )
a、b、c、d、e为元素周期表前3周期中的部分元素,它们在元素周期表中的相对位置如图所示.下列叙述正确的是( )| A. | b元素除0价外,只有一种化合价 | |
| B. | 五种元素中,c元素的性质最稳定 | |
| C. | d气态氢化物溶于水,溶液显碱性 | |
| D. | e元素最高价氧化物对应的水化物和不同量的氢氧化钠反应,可能生成三种盐 |
分析 a、b、c、d、e为元素周期表前3周期中的部分元素,由元素在周期表的位置可知,a、b、c、d、e分别是He、O、Si、Cl、P元素.
A.O元素有-1价、-2价;
B.He为2电子稳定结构;
C.d气态氢化物为HCl;
D.e元素最高价氧化物的水化物是磷酸,为三元酸.
解答 解:a、b、c、d、e为元素周期表前3周期中的部分元素,根据它们在元素周期表中的相对位置知,a、b、c、d、e分别是He、O、Si、Cl、P元素.
A.b是O元素,O元素除了0价外还有-1价、-2价,故A错误;
B.稀有气体单质的性质最稳定,所以五种元素中,a元素的单质性质最稳定,故B错误;
C.d的气态氢化物的水溶液是稀盐酸,溶液呈酸性,故C错误;
D.e元素最高价氧化物的水化物是磷酸,与氢氧化钠反应可以得到Na3PO4、Na2HPO4、NaH2PO4,故D正确;
故选D.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物为解答本题的关键,侧重分析与应用能力的考查,注意原子结构决定元素的性质,题目难度不大.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 | |
| B. | 苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯 | |
| C. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| D. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 H2O2$\frac{\underline{\;催化剂\;}}{\;}$2 H2O+O2↑ | B. | 2 Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3 H2O | ||
| C. | Fe2O3+3 CO$\frac{\underline{\;高温\;}}{\;}$2 Fe+3 CO2 | D. | Cl2+H2O═HCl+HclO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | C>A>D>B | C. | A>C>D>B | D. | B>D>C>A |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com