
| A、在实验室里硅酸钠溶液存放在带橡胶塞的试剂瓶中 |
| B、提倡人们购物时不用塑料袋,是为了防止白色污染 |
| C、氟利昂(CCl2F2)因破坏大气臭氧层而导致“温室效应” |
| D、为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定管出口部分开始有气泡,滴定后气泡消失 |
| B、锥形瓶用蒸馏水冲洗后随即使用 |
| C、当看到锥形瓶中溶液的颜色发生变化后随即停止了滴定 |
| D、滴定管在用蒸馏水洗净后,即装入标准的酸溶液进行滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
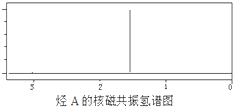 某烃A经李比希元素分析实验测得碳的质量分数为85.71%,该烃的质谱图显示:分子离子峰的最大质荷比为84,该烃的核磁共振氢谱如图所示.红外光谱表明分子中没有碳碳双键,已知烯烃经臭氧作用发生反应:
某烃A经李比希元素分析实验测得碳的质量分数为85.71%,该烃的质谱图显示:分子离子峰的最大质荷比为84,该烃的核磁共振氢谱如图所示.红外光谱表明分子中没有碳碳双键,已知烯烃经臭氧作用发生反应:| ①O3 |
| ②H2O |
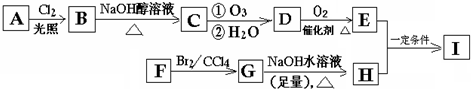
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Mg2+、Cl-、ClO- |
| B、NH3?H2O、SO32-、K+、Na+ |
| C、Fe2+、Na+、K+、NO3- |
| D、K+、Ca2+、Br-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
3 2 |
3 2 |
4 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验目的 | 实验操作 |
| A | 测定某溶液的pH | 用玻璃棒蘸取该溶液点在pH试纸中间 |
| B | 加快锌与稀硫酸制取H2的速率 | 在稀硫酸中滴加少量CuSO4溶液 |
| C | 证明醋酸是弱电解质 | 将CH3COONa晶体加入水中,会促进水的电离平衡 |
| D | 制取无色AlCl3 | 加热蒸发AlCl3溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
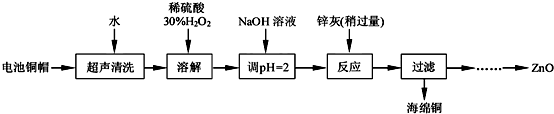
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.0 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com