
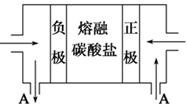
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
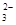 CO2 (3)CO
CO2 (3)CO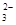 c
c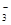 )>c(SO
)>c(SO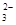 )>c(OH-)>c(H+) ②Cu2+ <
)>c(OH-)>c(H+) ②Cu2+ <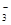 )>c(SO
)>c(SO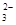 )>c(OH-)>c(H+)。
)>c(OH-)>c(H+)。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源:不详 题型:单选题
| A.在该条件下,反应前后的压强之比为6:5.3 |
| B.若反应开始时容器体积为2L,则v(SO3)=0.35mol/(L?min) |
| C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4mol |
| D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于QkJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该溶液的pH=5 |
| B.由CH3COOH电离出的c(H+)约为水电离出的c(H+)的106倍 |
C.CH3COOH的电离平衡常数约为1×10-6 |
| D.升高温度,溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
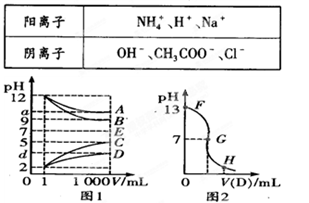
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加少量盐酸 | B.加热 | C.加少量醋酸钠晶体 | D.加氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) |
| B.0.1 mol·L-1 NH4Cl溶液:c(NH4+)=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+) > c(CH3COO-) > c(H+) > c(OH-) |
| D.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+) > c(Cl-) > c(OH-) > c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com