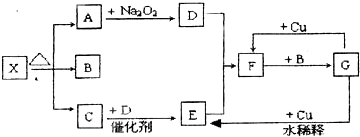
����������A��B��C��D��E��F��G��X������ת����ϵ��������A��C��DΪ��ɫ���壬BΪ��ɫҺ�壬��ΪX�ֽ�����B��H
2O��
C��ʹʪ��ĺ�ɫʯ����ֽ��������C��NH
3��
A����ɫ���壬���ܺ������Ʒ�Ӧ������ɫ���壬AΪCO
2��D��O
2��
������������������NO����E��NO��NO��������Ӧ����NO
2������F��NO
2��NO
2��ˮ��Ӧ���������NO����G��HNO
3��
X�ֽ�����CO
2��H
2O��NH
3��������ƽ����Է�������Ϊ24������X�ǣ�NH
4��
2CO
3��������ӦΪ��NH
4��
2CO
3CO
2��+H
2O+2NH
3������ƽ����Է�������=
=24������X��NH
4��
2CO
3���ٽ����Ŀ�������
���
�⣺����A��B��C��D��E��F��G��X������ת����ϵ��������A��C��DΪ��ɫ���壬BΪ��ɫҺ�壬��ΪX�ֽ�����B��H
2O��
C��ʹʪ��ĺ�ɫʯ����ֽ��������C��NH
3��
A����ɫ���壬���ܺ������Ʒ�Ӧ������ɫ���壬AΪCO
2��D��O
2��
������������������NO����E��NO��NO��������Ӧ����NO
2������F��NO
2��NO
2��ˮ��Ӧ���������NO����G��HNO
3��
X�ֽ�����CO
2��H
2O��NH
3��������ƽ����Է�������Ϊ24������X�ǣ�NH
4��
2CO
3��������ӦΪ��NH
4��
2CO
3CO
2��+H
2O+2NH
3������ƽ����Է�������=
=24������X��NH
4��
2CO
3��
��1��ͨ�����Ϸ���֪��X��F��G�ֱ��ǣ�NH
4��
2CO
3��NO
2��HNO
3���ʴ�Ϊ����NH
4��
2CO
3��NO
2��HNO
3��
��2��F��GΪ����������ˮ�ķ�Ӧ������ʽΪ3NO
2+H
2O=2HNO
3+NO��G��EΪͭ��ϡ����ķ�Ӧ������ʽΪ3Cu+8HNO
3=3Cu��NO
3��
3+2NO��+4H
2O��
�ʴ�Ϊ��3NO
2+H
2O=2HNO
3+NO��3Cu+8HNO
3=3Cu��NO
3��
3+2NO��+4H
2O��
��3��C�ǰ�����������������ˮ�����ܶ�С�ڿ����ҳ����ºͿ�������Ӧ������ʵ�����C���������ſ��������ռ����ʴ�Ϊ�������ſ�����
��4������������Y��Z��Ԫ�������Լ���������X��ͬ�����У�Y���ȷֽ�IJ�����X��ȫ��ͬ������������ƽ����Է�������Ϊ26.33����������NH
4HCO
3��
Z���ȷֽ�����в�����A��B��C����������һ�ֿ�ȼ������H������Ԫ���غ�֪���ÿ�ȼ������ΪCO����������������ʵ���֮��Ϊ1��1��1��1����÷��ӵĻ�ѧʽΪNH
4HC
2O
4���ʴ�Ϊ��NH
4HCO
3��NH
4HC
2O
4��





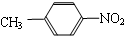
 ��1����Ԫ������Ҫ�ķǽ���Ԫ�أ����γ�±���������������P�����ȶ��ֻ����
��1����Ԫ������Ҫ�ķǽ���Ԫ�أ����γ�±���������������P�����ȶ��ֻ����
 ��1�����dz��ô�����ѡ��Ӧ���еķ�����ͼ��ʾΪһ��������1mol CH3OH��O2������Ӧʱ������CO��CO2��HCHO�������仯ͼ[��Ӧ��O2��g����������H2O��g����ȥ]��
��1�����dz��ô�����ѡ��Ӧ���еķ�����ͼ��ʾΪһ��������1mol CH3OH��O2������Ӧʱ������CO��CO2��HCHO�������仯ͼ[��Ӧ��O2��g����������H2O��g����ȥ]�� ��ͼ����ȡ�屽��װ�ã��Իش�
��ͼ����ȡ�屽��װ�ã��Իش�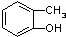 ��
�� ��
�� ��
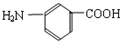
��
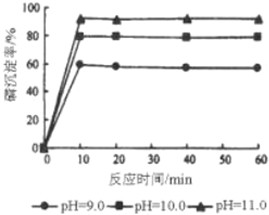
 ����Ӧ��ԭ���ԭ�������˶��ֵ�أ������㲻ͬ����Ҫ������ÿС���еĵ�ع㷺ʹ�����ճ���������Ϳ�ѧ�����ȷ��棬����������ṩ����Ϣ����д�ո�
����Ӧ��ԭ���ԭ�������˶��ֵ�أ������㲻ͬ����Ҫ������ÿС���еĵ�ع㷺ʹ�����ճ���������Ϳ�ѧ�����ȷ��棬����������ṩ����Ϣ����д�ո�