
【题目】研究化学反应的快慢和限度具有十分重要的意义。
回答下列问题:
(1)反应2SO2(g) + O2(g)![]() 2SO3(g)是制备硫酸的重要反应,该反应为放热反应。降低温度,逆反应的速率_________;使用催化剂V2O5,正反应的速率__________ (以上填“增加”、“不变”或“减小”), 催化剂对该反应的平衡状态_________影响(“有”或“无”)。
2SO3(g)是制备硫酸的重要反应,该反应为放热反应。降低温度,逆反应的速率_________;使用催化剂V2O5,正反应的速率__________ (以上填“增加”、“不变”或“减小”), 催化剂对该反应的平衡状态_________影响(“有”或“无”)。
(2)常温下,实验室用100 mL 6.0 mol·L-1硫酸跟足量锌粉反应制取氢气。
①为降低反应进行的速率,又不影响生成氢气的量,可向反应物中加入____(填序号 )。
A.CH3COONa固体 B.KNO3固体
C.K2SO4溶液 D.KHSO4溶液
②向溶液中滴加少量硫酸铜溶液,反应速率加快,原因是___________________。
(3)一定温度下,在体积固定的密闭容器中,有色气体N与无色气体M的物质的量随时间变化曲线如图所示。图中能够表明起始加入的物质是__________________,反应达平衡的时间是____________,该反应的化学方程式可表示为______________________________;下列说法中能够判定该反应处于平衡状态的是______________填 序号)。

A.容器的压强不再变化
B.气体的颜色不再变化
C.每反应2 mol的N生成1 mol的M
D.气体的密度不再发生变化
【答案】 减小 增加 无 AC 锌与硫酸铜反应置换出的铜,铜、锌和稀硫酸三者形成原电池,反应加快 M和N t3 2N![]() M AB
M AB
【解析】(1)降低温度,正反应和逆反应速率均减小;使用催化剂,降低了反应所需的活化能,提高了反应速率,故正反应速率增大,使用催化剂对化学平衡没有影响;正确答案:减小 ;增加 ;无。
(2)①硫酸为强酸,与CH3COONa反应生成弱酸醋酸,酸由强变弱,反应速率降低,但酸的总量不变,不影响生成氢气的量,A正确;KNO3固体溶解后完全电离产生NO3-,在酸性环境下具有强氧化性,与锌粉发生氧化还原反应产生NO,使生成氢气的量减少,B错误;加入 K2SO4溶液相当于稀释了反应物硫酸的浓度,反应速率降低,但是H+的物质的量不变,不影响生成氢气的量,C正确;KHSO4溶液完全电离产生H+,使溶液中的H+的物质的量增大,使生成氢气的量增大,D错误;综上所述,正确答案AC。
②锌与硫酸铜反应置换出的铜,铜、锌和稀硫酸三者形成原电池,反应速率加快;正确答案:锌与硫酸铜反应置换出的铜,铜、锌和稀硫酸三者形成原电池,反应速率加快。
(3 反应达到平衡时,反应物与生成物的物质的量均保持不变,故在t3时刻反应达到平衡;由图知,反应物为N,生成物为M,反应达到平衡时,二者消耗的物质的量之比为n(N):n(M)=(8-2):(5-2)=2:1,故该反应的化学方程式可表示为2N(g) ![]() M(g);该反应为非等体积反应,混合气体的总物质的量不变,压强也不再变化,反应达到平衡状态,A正确;N为有色气体、M为无色气体,当气体的颜色不再变化时,反应物N的物质的量不再变化,此时反应处于平衡状态,B正确。每反应2mol的N生成1mol的M只描述了正反应方向,不能判定该反应处于平衡状态,C错误;该反应中反应物与生成物均为气体,不论反应是否达到平衡状态,混合气体的质量均保持不变,且该反应在容积固定的密闭容器中进行,由
M(g);该反应为非等体积反应,混合气体的总物质的量不变,压强也不再变化,反应达到平衡状态,A正确;N为有色气体、M为无色气体,当气体的颜色不再变化时,反应物N的物质的量不再变化,此时反应处于平衡状态,B正确。每反应2mol的N生成1mol的M只描述了正反应方向,不能判定该反应处于平衡状态,C错误;该反应中反应物与生成物均为气体,不论反应是否达到平衡状态,混合气体的质量均保持不变,且该反应在容积固定的密闭容器中进行,由![]() 知,在整个反应过程中,气体的密度不发生变化,D错误;正确选项AB;正确答案:M和N;t3 ;2N
知,在整个反应过程中,气体的密度不发生变化,D错误;正确选项AB;正确答案:M和N;t3 ;2N![]() M ; AB。
M ; AB。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】芳香族有机物A(C11H12O2)可用作果味香精,用含碳、氢、氧三种元素的有机物B和C为原料可合成A.请按所给信息及相关要求填空:
(1)有机物B的蒸气密度是同温同压下氢气密度的23倍,分子中碳、氢原子个数比为1:3.有机物B的分子式为 .
(2)有机物C的分子式为C7H8O,C能与钠反应,不与碱反应,也不能使溴的四氯化碳溶液褪色.C的名称为
(3)已知两个醛分子间能发生如下反应(R、R′表示氢原子或烃基): ![]() 用B和C为原料按如下路线合成A:
用B和C为原料按如下路线合成A:
①上述合成过程中涉及的反应类型有:(填写序号)
a.取代反应 b.加成反应 c.消去反应 d.氧化反应 e.还原反应
②F的结构简式为: .
③G和B反应生成A的化学方程式: .
(4)F的同分异构体有 多种,写出既能发生银镜反应又能发生水解反应,且苯环上只有一个取代基的所有同分异构体的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( ) 
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)水中溶解氧是水生生物生存不可缺少的条件.某课外小组采用碘量法测定学校周边河水中的溶解氧.实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样.记录大气压及水体温度.将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2 , 实现氧的固定.
Ⅱ.酸化,滴定
将固氧后的水样酸化,MnO(OH)2被I﹣还原为Mn2+ , 在暗处静置5min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O32﹣+I2=2I﹣+S4O62﹣).
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是 .
(2)“氧的固定”中发生反应的化学方程式为 .
(3)Na2S2O3溶液不稳定,使用前需标定.配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除及二氧化碳.
(4)取100.00mL水样经固氧、酸化后,用a molL﹣1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为mgL﹣1 .
(5)上述滴定完成后,若滴定管尖嘴处留有气泡会导致测量结果偏 . (填“高”或“低”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途.某化学兴趣小组对绿矾的一些性质进行探究.回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化.再向试管中通入空气,溶液逐渐变红.由此可知:、 .
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g.将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g.按下图连接好装置进行实验.
①仪器B的名称是 .
②将下列实验操作步骤正确排序(填标号);重复上述操作步骤,直至A恒重,记为m3 g.
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2 , 缓缓通入N2e.称量Af.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示).若实验时按a、d次序操作,则使x(填“偏大”“偏小”或“无影响”).
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2 , 缓缓通入N2 , 加热.实验后反应管中残留固体为红色粉末.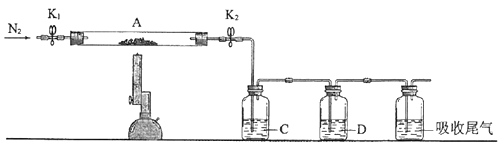
①C、D中的溶液依次为(填标号).C、D中有气泡冒出,并可观察到的现象分别为 .
a.品红b.NaOHc.BaCl2d.Ba(NO3)2e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常熟的值为NA . 下列说法正确的是( )
A.1L0.1molL﹣1NH4CL溶液中,NH4+的数量为0.1NA
B.2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是人体健康必需的一种微量元素。已知Se的原子结构示意图为: 。下列说法不正确的是( )
。下列说法不正确的是( )
A. 该元素处于第四周期第ⅥA族 B. SeO2既有氧化性又有还原性
C. 该原子的质量数为34 D. 酸性:HBrO4 > H2SeO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com