
NaNO2是一种食品添加剂,它能致癌。酸性 KMnO4溶液与 NaNO2。的反应方程式是MnO4-+NO2-+□→Mn2++NO3-+H2O。下列叙述中正确的是( )
A.该反应中 NO2?被还原 B.反应过程中溶液的pH 减小
C.生成1 mol NaNO3需消耗 0.4mol KMnO4 D.□中的粒子是 OH-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届江苏省高三上12月月考化学卷(解析版) 题型:实验题
直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m (n>2,m≤10)的实验流程如下:

已知:盐基度=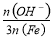 ×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产
×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产 品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
(1)实验加入硫酸的作用是____________,取样分析Fe2+浓度,其目的是___________。
(2)用pH试纸测定溶液pH的操作方法为____________,若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数____________(填“偏高”、“偏低”、“无影响”)
(3)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2]?[Fe2(OH)n(SO4)3-n/2]m,则水解反应的化学方程式为____________.
(4)产品盐基度的测定方法:
Ⅰ称取m g固体试样,置于400mL聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.
Ⅱ室温下放置10min,再加入10mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀.
Ⅲ加入5滴酚酞指示剂,立即用物质的量浓度为c mol•L-1的氢氧化钠标准液滴定至终点,消耗体积为VmL.
Ⅳ向聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0mL.
①达到滴定终点的现象为____________。
②已知试样中Fe3+的质量分数为a,则该试样的盐基度的计算表达式为________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上周考五化学试卷(解析版) 题型:推断题
【化学—选修5:有机化学基础】
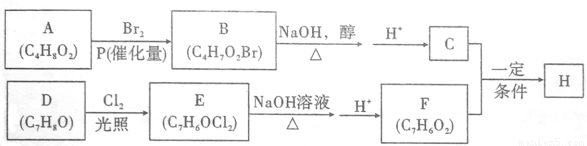
化合物H的分子中含有醛基和酯基,H可以用C和F在一定条件下合成(如图);
已知以下信息:
①A的核磁共振氢谱中有三组峰;且能与饱和碳酸氢钠溶液反应放出CO2。
②
③化合物D苯环上的一氯代物只有两种。
④通常同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)A的化学名称_____________________;(系统命名法)
(2)B的结构简式为_____________________;
(3)D生成E的化学方程式为_____________________,该反应类型为___________;
(4)F的结构简式为______________;
(5)H在一定条件下反应生成高聚物的化学方程式为______________;
(6)F的同系物G比F相对分子质量大14,G的同分异构体中能同时满足如下条件:①苯环上只有两个取代基;不能使FeCl3溶液显色,共有_______种(不考虑立体异构)。G的一个同分异构体被酸性高锰酸钾溶液氧化后核磁共振氢谱为两组峰,且峰面积比为2:1,写出G的这种同分异构体的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上五调考试化学卷(解析版) 题型:选择题
A、B、C、D、E是原子序数依次增大的五种短周期元素且B、C相邻,A元索可以与B、C、E元素分别形成甲、乙、丙三种物质且甲、乙均为10电子化合物,丙为18电子化合物。D元索的最外层电子数与核外电子层数相等。已知:甲+E2=丙+ Br2,甲+丙=丁,下列说法中正确的是( )
A. 离子半径:D>C>B
B. A与B两种元素共同形成的10电子粒子有3种
C. D元素在周期表中的位置是第二周期第ⅡA族
D. 丁物质均由非金属元索构成,只含共价键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一月考二化学卷(解析版) 题型:计算题
在铁和氧化铁的混合物 15 g 中加入150 mL 稀 H2SO4 放出氢气 1.68 L(标准状况下)。当反应停止后,铁与氧化铁均无剩余,且溶液中没有 Fe 3+存在。为了中和过量 H2SO4,并使 Fe 2+ 完全转化为 Fe(OH) 2沉淀,共耗用 3 mol·L-1 NaOH 溶液 200 mL。
(1) 写出溶液中反应的化学方程式:___________________;_____________________;______________________。
(2) 混合物中铁的质量为________,氧化铁的质量为________。
(3) 稀 H 2 SO 4的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一月考二化学卷(解析版) 题型:选择题
某无色透明溶液与金属铁反应时只放出氢气,则溶液中可以大量共存的离子是( )
A.Na+、CH3COO-、H+、NH4+ B.H+、NO3-、Ba2+、Mg2+
C.Na+、Cl-、H+、SO42- D.Ba2+、K+、SO32-、S2-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一月考二化学卷(解析版) 题型:选择题
有 9.7gCu 和 Zn 的合金与足量的稀 HNO3反应, 还原产物只有 NO 气体, 其体积在标准状况下为 22.4L。 将溶液稀释为 1L, 测得溶液的 C(H+)=0.1 mol/L, 此时溶液中 NO3-的浓度为( )
A.0.3mol/L B.0.4mol/L C.0.5mol/L D. 0.6mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:选择题
下列说法中错误的是
A.卤化氢中,HF的沸点最高,是由于HF分子间存在氢键
B.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低
C.H2O的沸点比HF的沸点高,是由于水中氢键键能大
D.氨气极易溶于水与氨气分子和水分子间形成氢键有关
查看答案和解析>>
科目:高中化学 来源:2017届江西师大附中高三12月月考化学试卷(解析版) 题型:选择题
图甲是CO2电催化还原为碳氢化合物(CxHy)的工作原理示意图,用某钾盐水溶液做电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,用硫酸为电解质溶液。下列说法中不正确的是
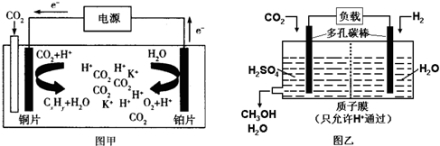
A.甲中铜片作阴极,K+向铜片电极移动
B.甲中若CxHy为C2H4,则生成1mol C2H4的同时生成3mol O2
C.乙中H2SO4的作用是增强溶液的导电性
D.乙中正极发生的电极反应为CO2+5e-+6H+═CH3OH+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com