
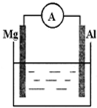
 如图所示装置:
如图所示装置:分析 (1)若烧杯中溶液为稀硫酸,该装置符合原电池构成条件,所以能构成原电池,则电流表指针发生偏转,Mg易失电子作负极、Al作正极,负极反应式为Mg-2e-=Mg2+、正极反应式为2H++2e-=H2↑;
(2)若烧杯中溶液为氢氧化钠溶液,碱性条件下,Al易失电子作负极、Mg作正极,Al和NaOH、H2O反应生成NaAlO2、H2.
解答 解:(1)若烧杯中溶液为稀硫酸,该装置符合原电池构成条件,所以能构成原电池,则电流表指针发生偏转,Mg易失电子作负极、Al作正极,负极反应式为Mg-2e-=Mg2+、正极反应式为2H++2e-=H2↑,所以看到的现象是:镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转,
故答案为:镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;2H++2e-=H2↑;Mg-2e-=Mg2+;
(2)若烧杯中溶液为氢氧化钠溶液,碱性条件下,Al易失电子作负极、Mg作正极,负极反应式为Al+4OH--3e-═AlO2-+2H2O,正极反应式为2H2O+2e-=H2↑+2OH-,电池反应式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al;2H2O+2e-=H2+2OH-;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 电极反应式的书写要注意结合电解质溶液酸碱性、物质的性质,不能根据金属的活泼性强弱判断正负极,为易错点.


科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是( )
A.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+
B.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含Cu2+和Fe3+
C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+
D.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:选择题
铁矿石(主要成份FeS)与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为4∶1∶4时,实际参加反应的FeS与HNO3的物质的量之比为
A.16∶25 B.1∶7 C.1∶6 D.2∶11
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHCH(CH3)2:2-二甲基丁烷 | B. | CH3CH(OH)CH(CH3)2:3-甲基-2-丁醇 | ||
| C. | 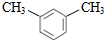 :1,4-二甲苯 :1,4-二甲苯 | D. | 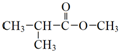 :正丁酸甲酯 :正丁酸甲酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三硫代碳酸钾 | B. | 多硫碳化钾 | C. | 过硫碳酸钾 | D. | 超硫碳酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少许某溶液,滴加数滴KSCN溶液,无明显现象;再另取少许原溶液,先滴少量新制氯水,再滴加数滴KSCN溶液,溶液变血红色,则原溶液中一定含Fe2+ | |
| B. | 焰色反应时,用稀硫酸洗净铂丝,并在火焰上灼烧至无色,然后蘸取溶液 | |
| C. | 在淀粉溶液中加入稀硫酸并加热片刻后,再加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 | |
| D. | 测定某溶液的pH,常用干燥洁净的玻璃棒蘸取该溶液滴在润湿的pH试纸上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com