
| A. | 某无色溶液中:Al3+、Cu2+、SO${\;}_{4}^{2-}$、Cl- | |
| B. | 由水离子的c(H+)=1×10-12mol•L-1的溶液中:Ba2+、K+、Cl-、NO${\;}_{3}^{-}$ | |
| C. | c(OH-)/c(H+)═1012的溶液中:Na+、Mg2+、NO${\;}_{3}^{-}$、Cl- | |
| D. | 含有大量HCO${\;}_{3}^{-}$的溶液中:NH${\;}_{4}^{+}$、Al3+、Ca2+、Cl- |
分析 A.无色溶液中有颜色的离子不能大量存在;
B.由水离子的c(H+)=1×10-12mol•L-1的溶液可能呈酸性或碱性;
C.c(OH-)/c(H+)═1012的溶液呈碱性;
D.与HCO3-反应的离子不能大量共存.
解答 解:A.Cu2+有颜色,不能大量存在,故A错误;
B.由水离子的c(H+)=1×10-12mol•L-1的溶液可能呈酸性或碱性,无论呈酸性还是碱性,离子之间都不发生任何反应,可大量共存,故B正确;
C.c(OH-)/c(H+)═1012的溶液呈碱性,碱性条件下Mg2+不能大量共存,故C错误;
D.Al3+与HCO3-发生互促水解而不能大量共存,故D错误.
故选B.
点评 本题考查离子的共存,为高考常见题型,侧重学生思维严密性的考查,注意把握习题中的信息是解答的关键,熟悉离子的性质及反应即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | 1.8×10-5 | 3.0×10-8 | Ka1=4.1×10-7Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时c(CH3COOH):c(CH3COO-)=9:5 | |
| C. | 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大 | |
| D. | 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8 mol•L-1•s-1 | B. | v(A2)=0.4 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(B2)=1.8 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
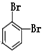 和
和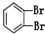 ④CH4和CH3CH2CH3; ⑤葡萄糖与果糖;⑥16O和18O.
④CH4和CH3CH2CH3; ⑤葡萄糖与果糖;⑥16O和18O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
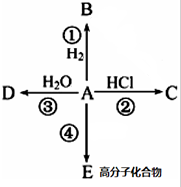 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下课发生如图所示的转化,请回答下列问题.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下课发生如图所示的转化,请回答下列问题.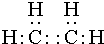 ,D中所含的官能团为羟基.
,D中所含的官能团为羟基.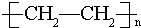 ,反应类型为加聚反应.
,反应类型为加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、氯乙烯、苯乙烯都是不饱和烃,均可用于合成有机高分子材料 | |
| B. | 苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 | |
| C. | 酒越陈越香是因为酒中含有的有机酸与乙醇生成了酯 | |
| D. | 糖类、蛋白质、脂肪都是重要的营养物质,它们都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3- | B. | NO3- | C. | NH${\;}_{4}^{+}$ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
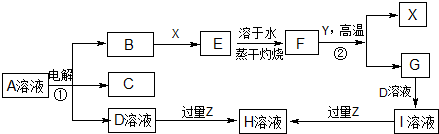
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com