
| A. | 金属性:Li<Na<K | B. | 沸点:HF<HCl<HBr<HI | ||
| C. | 稳定性:HCl>H2S>PH3 | D. | 还原性:F-<Cl-<Br- |
分析 A.同主族,从上到下金属性增强;
B.HF分子之间含氢键,沸点最大;
C.非金属性越强,氢化物越稳定;
D.非金属性越强,对应阴离子还原性越弱.
解答 解:A.同主族,从上到下金属性增强,则金属性为K>Na>Li,故A正确;
B.HF形成了氢键,所以HF的沸点最高.由分子构成结构相似的相对分子质量越大的,其沸点就会越高,所以四种物质的沸点顺序为HCl<HBr<HI<HF,故B错误;
C.元素的非金属性越强,其气态氢化物的稳定性就越强,而三种元素中,同一周期中从左至右气态氢化物的稳定性会递增,稳定性:HCl>H2S>PH3,故C正确;
D.离子的还原性与元素的非金属性呈反比,F,Cl,Br的非金属性是依次递减的,所以还原性的顺序为F-<Cl-<Br-,故D正确;
故选B.
点评 本题考查周期表和周期律,为高频考点,把握元素的性质及周期律为解答的关键,侧重分析与应用能力的考查,注意短周期元素的性质比较及规律性知识的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
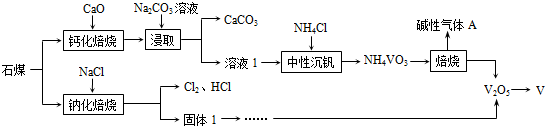
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 、
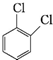
、
| A. | ①②③⑤④ | B. | ③⑤④①② | C. | ④②①⑤③ | D. | ③④②①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
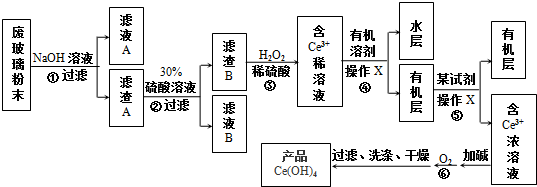
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
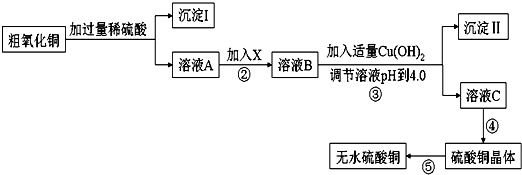
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,丁香油酚不应具有的化学性质是( )
,丁香油酚不应具有的化学性质是( )| A. | 可以发生加聚反应 | B. | 可以与强碱溶液反应 | ||
| C. | 与NaHCO3反应放出CO2 | D. | 可与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol稀H2SO4与足量NaOH溶液反应 | |
| B. | 稀醋酸与NaOH溶液反应生成1mol H2O | |
| C. | 稀盐酸与稀Ba(OH)2溶液反应生成1mol H2O | |
| D. | 稀NaOH与95%浓硫酸反应生成1mol H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 等质量的乙烷、乙烯、乙炔在氧气中完全燃烧,乙烷消耗的氧气最多 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 可向溴乙烷中加入硝酸银溶液检验溴元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com