
下列过程中,共价键被破坏的是( )
A.碘升华 B.二氧化氮被木炭吸附
C.酒精溶于水  D.HCl气体溶于水
D.HCl气体溶于水
科目:高中化学 来源: 题型:
将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是 ( )。
A.标准状况下,反应过程中得到6.72 L气体B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C.最终得到7.8 g沉淀
D.最终得到的溶液中c(Na+)=1.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到预期目的是
A.向某无色液中加BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有SO42-
B.向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有CO32-
C.向某溶液滴加AgNO3溶液产生白色沉淀,说明原溶液一定含有Cl-
D.向某溶液加入NaOH溶液产生蓝色沉淀,说明原溶液一定含有Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能说明Cl原子的得电子能力比S原子强的是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强 ④Cl2能与 H2S反应生成S
H2S反应生成S
⑤Cl原子最外层有7个电于,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①②
C.①②④ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
位于短周期的四种元素A、B、C、D,其原子序数依次增大。A在周期表中原子半径最小;B是地壳中含量最高的元素;B、D位于 同一主族;C的原子半径在同周期中最大。
同一主族;C的原子半径在同周期中最大。
回答下列问题:
(1)写出由上述元素形成的具有漂白作用的3种物质的化学式:________、________、________。
(2)写出含B元素质量分数最高的化合物的电子式:_________________________
____________________________ ____________________________________________。
____________________________________________。
(3)分别由A、B、C、D四种元素组成的两种化合物X和Y可以发生反应,试写出该反应的离子方程式:
_______________________________________________________。
(4)用电子式表示化合物C2B的形成过程:
__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下面所 列的是一组你熟悉的物质:
列的是一组你熟悉的物质:
①HCl ②CO2 ③H2O ④H2 ⑤NaOH ⑥Cl2
⑦NaF ⑧CH4 ⑨CaO ⑩MgCl2
(1)只含有共价键的是___ _____,只含有离子键的是________,既含离子键,又含有共价键的是________。
_____,只含有离子键的是________,既含离子键,又含有共价键的是________。
(2)属于共价化合物的是________,属于离子化合物的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z都是短周期元素,它们的原子序数依次增大,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y 和Z可以形成两种以上气态化合物,则下列说法错误的是( )
A.Y和Z可以组成一种Y和Z的质量比为7∶8的化合物
B.X、Y、Z可以组成一种盐
C.X和Z可以组成原子个数比分别为1∶1和2∶1常温下呈液态的两种化合物
D.由X、Y、Z三种元素中的任意两种组成的10电子微粒有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
把500mL有BaCl2和KCl的混合溶液分成二等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为 ( )
A.0.25(b-2a)mol/L B.4(2a-b)mol/L
C.2(b-2a)mol/L D.4(b-2a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2。某同学受此启发,提出一个相似的观点:即当足量Cl2与铁反应时
 则生成FeCl3,当少量Cl2与足量铁反应时则生成FeCl2。为验证该观点是否正确,该同学设计了以下实验。
则生成FeCl3,当少量Cl2与足量铁反应时则生成FeCl2。为验证该观点是否正确,该同学设计了以下实验。
(1)制取Cl2。下列装置能用来制备、收集干燥纯净Cl2的有_____ ___(填代号)。
___(填代号)。
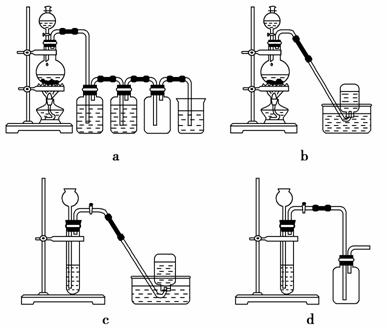
(2)制备反应产物。将一根细的纯铁丝分别在足量和少量的Cl2中点燃。取其表面生成物并分别编号为A、B,然后通过实验确定其成分。
(3)探究过程如下:
①提出假设:A是FeCl3,B是FeCl2 。
。
②设计实验方案:分别取A、B的溶液进行以下实验,但实验现象相同。请填写下表中的空格。
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | _______ | 固体物质中有FeCl3 |
| 向KMnO4溶液中分别加适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含________ |
③实验结论,写出Cl2与铁粉加热时发生反应的化学方程式:___________________________________________________________。
(4)实际应用:FeCl3可用做催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com