
在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)  CH3OH(g)+H2O(g) △H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是
CH3OH(g)+H2O(g) △H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是
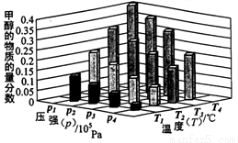
A.P3>P2 T3>T2
B.P2>P4 T4>T2
C.P1>P3 T3>T1
D.P1>P4 T2>T3
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源:2014-2015黑龙江省鸡西市龙东南四校高二上学期期末联考化学试卷(解析版) 题型:填空题
(12分)(1)某研究性学习小组在实验室中配制1 mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是______________。
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60 mL 稀硫酸标准溶液,配制时应选用100 mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E.中和滴定时,若在最后一次读数时俯视读数,则导致最后实验结果偏大
(2)常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8。
①常温下,0.1 mol·L-1 HA溶液的pH= ;写出该酸(HA)与NaOH溶液反应的离子方程式: ;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是: ;
③0.2 mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合后所得溶液中:c(H+)+c(HA)-c(OH-)= mol·L-1。(溶液体积变化忽略不计)
(3)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw= 。该温度下(t℃),将100 mL 0.1 mol·L-1的稀H2SO4溶液与100 mL 0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH= 。
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省鸡西市龙东南七校高一上学期期末联考化学试卷(解析版) 题型:选择题
为了验证小苏打中是否含有纯碱,下列实验操作及判断正确的是
A.观察加热时是否放出气体
B.观察滴加盐酸时能否放出气体
C.溶于水中,再滴加石灰水,观察有无沉淀产生
D.溶于水中,滴加少量的氯化钡溶液,观察有无白色沉淀产生
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三3月联考理综化学试卷(解析版) 题型:选择题
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是
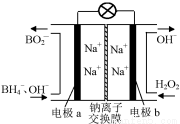
A.电池放电时Na+从b极区移向a极区
B.该电池的负极反应为:BH4-+8OH--8e-===BO2-+6H2O
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.每消耗3 mol H2O2,转移的电子为3 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:计算题
(2分)若25℃时,CH3 COOH的电离平衡常数Ka = 1.8×10-5,则该温度下0.18mol/L的CH3 COONa溶液的pH= (CH3 COONa水解程度很小,计算时可将CH3COO-的平衡浓度看成是CH3 COONa溶液的浓度)
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列表述正确的是
A.将 0.1 mol·L-1HCl溶液加热到100℃,溶液的pH仍为1
B.将pH=4的醋酸溶液加水稀释后,溶液中所有离子的浓度均降低
C.常温下,若1mLpH=1的盐酸与10mLNaOH溶液混合后溶液的pH=7,则NaOH溶液的pH=12
D.在滴有酚酞试液的氨水中,加入NH4Cl至溶液呈无色,此时溶液一定显中性
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)
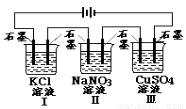
A.13、7、1 B.12、7、2
C.1、7、13 D.7、13、1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:填空题
肼(N2H4)又称联氨,其液体可燃,燃烧热较大且燃烧产物对环境无污染,可以用作火箭燃料。肼溶于水是一种二元碱。
完成下列填空:
(1)写出肼的电子式 ,肼的晶体类型 。
(2)工业上可用次氯酸钠和氨反应制肼,若只有一种氧化产物。写出该方法制备肼的化学方程式 。
(3)0.2mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出128.3kJ的热量。
写出该反应的热化学方程式 。
(4)室温下,N2H5Cl的水溶液显 (填酸、碱、中)性。
其原因是。
已知:H2O  H + + OH- Kw = 1×10-14
H + + OH- Kw = 1×10-14
N2H4 + H2O 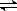 [N2H5]+ + OH- K1 = 8.5×10-7
[N2H5]+ + OH- K1 = 8.5×10-7
[N2H5]+ + H2O 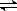 [N2H6]2++ OH- K2 = 8.4×10-15
[N2H6]2++ OH- K2 = 8.4×10-15
(5)肼可以和氧气反应N2H4+O2→N2+2H2O。为除去高压锅炉用水中溶解的O2,常用N2H4或Na2SO3。除去等物质的量的O2,所消耗的N2H4和Na2SO3的质量之比为 。
与N2H4相比较,使用Na2SO3会对锅炉造成不良的影响,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com