
| 65g×6.4g |
| 64g |
| 6.4g×2mol |
| 64g |
| 6.4g |
| 64g/mol |
| 0.1mol |
| 0.05L |


科目:高中化学 来源: 题型:
| 催化剂 |
| A、使用催化剂是为了加快反应速率,提高生产效率 |
| B、上述条件下,SO2不可能100%转化为SO3; |
| C、达到平衡状态时,SO2浓度与SO3浓度相等 |
| D、达到平衡状态时,SO2的消耗速率与SO2的生成速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、C6H12O6
| |||
B、HC≡CH+HCl
| |||
C、 | |||
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| O2 |
| △ |
| 焙烧 |
| 足量稀盐酸 |
| 操作Ⅰ |
| 蒸发结晶过滤 |
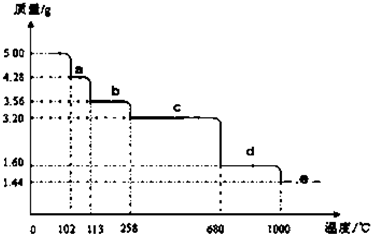
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| 1 |
| 2 |
| 容器编号 | c(CO)/mol?L-1 | c(O2)/mol?L-1 | c(CO2)/mol?L-1 | υ(正)和υ(逆) 大小比较 |
| ① | 2.0×10-4 | 4.0×10-4 | 4.0×10-4 | υ(正)=υ(逆) |
| ② | 1.0×10-3 | 4.0×10-4 | 5.0×10-4 | υ(正) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C |
①由C、H两种元素组成; ②球棍模型为  |
①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成相对分子质量为100的酯E |
①由C、H、O三种元素组成; ②球棍模型为  |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com